Резистентность клопов
Считается, что глобальное возрождение постельных клопов, как Cimex lectularius (L), так и Cimex hemipterus (F) за последние два десятилетия в значительной степени связано с развитием их резистентности к инсектицидам. Транскриптомные и геномные исследования, проводимые с 2010 года, а также морфологические, биохимические и поведенческие исследования, помогли изучить устойчивость постельных клопов к инсектицидам. Множественные механизмы невосприимчивости, в том числе резистентность к проникновению за счет утолщения или ремоделирования кутикулы, метаболическая невосприимчивость за счет повышенной активности ферментов детоксикации (монооксигеназы и эстеразы цитохрома P450s) и устойчивость к нокдауну с помощью kdr мутации, были экспериментально идентифицированы как придающие постельным клопам устойчивость к инсектицидам. Другие потенциальные механизмы резистентности, включая поведенческую устойчивость, некоторые виды физиологической невосприимчивости (повышение активности эстераз за счет точечных мутаций, глутатион-S-трансферазы, нечувствительность целевого участка, включая измененную AChEs (ацетилхолинэстеразы), нечувствительность к рецепторам ГАМК-А и измененные nAChRs (никотиновые ацетилхолиновые рецепторы), резистентность, опосредованную симбионтами), и другие потенциальные, но еще не открытые механизмы. В этой статье рассматриваются недавние исследования механизмов резистентности и генов, управляющих устойчивостью к инсектицидам, потенциальные механизмы невосприимчивости и методы мониторинга резистентности к инсектицидам у постельных клопов.
Причины развития резистентности у постельных клопов
Химическая обработка остается наиболее важной и широко используемой стратегией борьбы с большинством насекомых-вредителей во всем мире. Тем не менее, исследования показали, что множественные механизмы резистентности у насекомых обеспечивают устойчивость к целому ряду классов инсектицидов. В последнее время ученые использовали новые методы и достижения в геномных исследованиях (транскриптомное секвенирование и секвенирование всего генома) для выявления механизмов, определяющих устойчивость постельных клопов к инсектицидам (таблица 1). Предыдущие биопробы, генетические, морфологические, биохимические и поведенческие исследования также добились значительного прогресса в понимании механизмов резистентности к инсектицидам постельных клопов, таких как устойчивость к проникновению, метаболическая невосприимчивость и устойчивость к нокдауну. Этот обзор посвящен устойчивости к различным классам инсектицидов и лежащим в ее основе механизмам у постельных клопов. Также рассматриваются другие потенциальные механизмы резистентности постельных клопов.
Таблица 1. Прогресс в морфологической, поведенческой, биохимической, биопробной и генетической характеристике механизмов устойчивости к инсектицидам у постельных клопов
| Год | Характеристика | Цели | Методы | Регистрационный номер(а) | Механизмы сопротивления |
| C. lectularius | |||||
| 2009 | Поведенческий | — | Биотест: СК | — | Поведенческое сопротивление |
| 2009; 2015; 2016 | Биоанализ | Р450s; эстеразы | Биоанализ (SC/T) +синергисты (PBO, PBH, EN16/5–1) | Метаболическая резистентность: P450s, эстеразы | |
| 2008; 2011; 2016 | биохимический | Р450s; GSTs; эстеразы | Биохимические анализы | — | Метаболическая резистентность: P450, GST и эстеразы |
| 2016 | Морфологический | Кутикула | SEM | — | Сопротивление проникновению |
| 2008 | Генетический | VGSC | Клонирование и секвенирование (RACE) | FJ031996; FJ031997 | Нечувствительность целевого участка: kdr |
| 2011 | Генетический | Транскриптом | 454 пиросеквенирование (платформа Roche 454 GS FLX Titanium) | SRA024509 | Метаболическая устойчивость: P450s |
| 2011 | Генетический | Транскриптом | Высокопроизводительное секвенирование (платформа Roche 454 Titanium) | SRA043735 | Метаболическая резистентность: P450, GST и эстеразы; Нечувствительность целевого участка: kdr |
| 2012 | Генетический | РНК-последовательность | Высокопроизводительное секвенирование Illumina (платформа GAII) | GSE31823 | Метаболическая резистентность: P450s, GSTs, ABC-транспортеры, эстеразы; Сопротивление проникновению; Нечувствительность целевого участка: kdr |
| 2012 | Генетический | CPR | Клонирование и секвенирование (RACE) | JQ178363 | Метаболическая устойчивость: P450s |
| 2012 | Генетический | ClAChE1; ClAChE2; ClSChE | Клонирование и секвенирование (RACE) | JN563927; GU597837;GU597838;GU597839 | — |
| 2013 | Генетический | CPRR | Данные из NCBI | — | Сопротивление проникновению |
| 2013 | Генетический | Транскриптом | 454 пиросеквенирование (платформа Roche 454 GS FLX Titanium) | — | Метаболическая резистентность: P450s, эстеразы, ABC-транспортеры; Сопротивление проникновению; Нечувствительность целевого участка: kdr |
| 2016 | Генетический | Геном | Высокопроизводительное секвенирование Illumina (HiSeq2000s) | SRS580017 | Метаболическая резистентность: Р450, эстеразы, АВС-транспортеры, GSTs; Сопротивление проникновению; Нечувствительность целевого сайта: kdr |
| 2016 | Генетический | Геном; РНК-последовательность | Высокопроизводительное секвенирование Illumina | SRS749263; СРР1790655 | Нечувствительность участка-мишени: kdr, предполагаемые рецепторы ГАМК; Метаболическая резистентность: P450s, GSTs, эстеразы |
| C. hemipterus | |||||
| 2007 | биохимический | Р450s; GSTs; эстеразы | Биохимические анализы | — | Метаболическая устойчивость: GST и эстеразы |
| 2011 | Биоанализ | P450s | Биоанализ (SC) плюс PBO | — | Метаболическая устойчивость: P450s |
| 2015 | Генетический | VGSC (Part) | Секвенирование по Сэнгеру | — | Нечувствительность целевого участка: kdr |
Глобальное возрождение постельных клопов
Обыкновенный постельный клоп Cimex lectularius L. и тропический клоп Cimex hemipterus (F.) (Hemiptera: Cimicidae) являются эктопаразитами, которые приспособились питаться человеческой кровью в основном в ночное время суток. Cimex lectularius наиболее распространен в регионах с умеренным климатом, тогда как Cimex hemipterus встречается в основном в тропических и субтропических регионах. Однако есть регионы, где встречаются оба вида: Таиланд, Африка, Австралия, Флорида (США). Приблизительно 70% людей, укушенных C. lectularius, испытывают аллергические реакции в диапазоне от легких до тяжелых, включая зуд, эритематозную сыпь или крапивницу, хотя меньше людей реагируют на первоначальное воздействие. Для C. hemipterus процент популяции, вызывающей клиническую реакцию, неизвестен, при этом описаны кожные реакции, включая образование папулезных поражений с сопутствующим зудом, которые проходят примерно через 1 час после укуса. Кроме того, расчесы могут привести к вторичным бактериальным инфекциям, таким как целлюлит, импетиго, эктима и лимфангиты. Только у небольшого числа людей после повторных укусов постельных клопов видимого эффекта может не быть, и это отсутствие реакции может зависеть от предыдущего воздействия, хотя у некоторых людей реакция никогда не развивается, несмотря на множественные укусы с течением времени. Контролируемые лабораторные исследования показали, что постельные клопы способны передавать Trypanosoma cruzi (этиологический агент болезни Шагаса) и Bartonella quintana (этиологический агент траншейной или окопной (волынской) лихорадки). Однако на сегодняшний день нет доказательств, подтверждающих предположение о том, что постельные клопы передают человеку те или иные возбудители в их естественной среде обитания.
Постельные клопы давно связаны с людьми и были широко распространены во всем мире до Второй мировой войны. Вскоре были открыты современные инсектициды, такие как хлорорганический дихлордифенилтрихлорэтан (ДДТ), которые стали быстрым и недорогим методом борьбы с насекомыми-вредителями, включая постельных клопов. Как следствие, постельные клопы постепенно стали редкостью, особенно в развитых странах, во второй половине двадцатого века. К сожалению, за последние 15-20 лет постельные клопы возродились по всему миру. Недавние заражения постельными клопами были зарегистрированы в отелях и мотелях, домах и жилых комплексах, кинотеатрах, офисах, торговых точках, общественном транспорте, коммерческих рейсах, школах и медицинских учреждениях (включая неонатальные отделения). Предполагается, что несколько факторов, таких как увеличение количества местных и международных поездок, частый обмен подержанными вещами, плохая борьба с вредителями и устойчивость к инсектицидам, относятся к факторам, способствующим глобальному возрождению постельных клопов. Тем не менее, резистентность к инсектицидам в значительной степени инкриминируется как основная причина возвращения этих надоедливых вредителей.
Устойчивость постельных клопов к инсектицидам
Устойчивость к инсектицидам определяется как «наследственное изменение чувствительности популяции вредных организмов, которое отражается в повторяющейся неспособности средства (действующего вещества) достичь ожидаемого уровня контроля при использовании в соответствии с рекомендацией на этикетке для данного вида вредного организма». Другими словами, это унаследованная способность популяции выживать при смертельной концентрации инсектицидного продукта, которая обычно убивает дикую популяцию. Это происходит из-за аллелей (аллели – различные формы одного и того же гена, расположенные в одинаковых участках гомологичных хромосом, определяют направление развития конкретного признака), которые придают соответствующие факторы устойчивости, частота которых впоследствии увеличивается в ответ на применение инсектицидов. Однако устойчивость к инсектицидам не следует путать с толерантностью к инсектицидам. В отличие от устойчивости к инсектицидам, толерантность представляет собой естественную способность противостоять действию инсектицидов, а не результат генетических изменений, вызванных давлением отбора инсектицидов.
Устойчивость клопов к дихлордифенилтрихлорметилметану
ДДТ (дихлордифенилтрихлорметилметан) – действующее вещество пестицидов (инсектицид) был долговечным, относительно недорогим и неограниченным химическим веществом, которое использовалось во всем мире в качестве средства для борьбы с болезнетворными комарами, мухами и вшами после Второй мировой войны. Начиная с 1942 года, ДДТ активно использовался для борьбы с заражением постельными клопами в военных казармах. Первый случай неудачного применения ДДТ против клопов C. lectularius был зарегистрирован в 1947 году в казармах военно-морской приемной станции в Перл-Харборе, Гавайи. Примечательно, что постельные клопы, возможно, начали вырабатывать устойчивость к ДДТ в течение 5 лет после первого использования средства, и быстрый темп развития устойчивости, вероятно, был связан с чрезмерным и непрерывным использованием инсектицида.
К 1950-м годам устойчивость постельных клопов к ДДТ была широко распространена во всем мире. В этот период также наблюдалась перекрестная устойчивость к пиретринам как у C. lectularius (из Израиля), так и у C. hemipterus (из Танзании). Хотя существует множество литературы, демонстрирующей, что постельные клопы выработали заметную устойчивость к ДДТ, заражение постельными клопами резко сократилось и фактически опустилось до очень низкого уровня с 1950-х до конца 1970-х годов во многих развитых странах. Повторяющееся и широко распространенное использование ДДТ и последующих инсектицидов (малатион, хлорпирифос и пропоксур) привело к значительному снижению заражения постельными клопами во всем мире. Тем не менее, заражение постельными клопами все еще было серьезной проблемой в некоторых развивающихся странах, таких как Сьерра-Леоне, Южная и Центральная Африка, а также являлось проблемой в птицеводстве во многих других странах.
Пиретроидная устойчивость постельных клопов
Пиретроиды, синтетические аналоги пиретрина в пиретруме, экстракте цветков Chrysanthemum cinerariaefolium, представляют собой класс высокоэффективных и чрезвычайно нейротоксичных инсектицидов. Однако с возрождением постельных клопов во всем мире за последние два десятилетия устойчивость к пиретроидам (таблица 2) была зарегистрирована во многих частях мира как для Cimex lectularius, так и для Cimex hemipterus.
Таблица 2. Опубликованные отчеты об устойчивости к инсектицидам и эффективности веществ в отношении современных постельных клопов после 2000 года
| Год | Инсектицид | Метод | Местоположение / штамм | Восприимчивость / эффективность | Коэффициент сопротивления |
| C. lectularius | |||||
| 2006 | α-циперметрина | SC | Великобритания (3 полевых штамма) | Устойчивый | — |
| 2006 | Бендиокарбb | SC | Великобритания (3 полевых штамма) | Устойчивый | — |
| 2006 | Дельтаметринa | SC | США (Арлингтон, Вирджиния) | Устойчивый | >300 |
| 2006 | Хлорфенапирg | SC | Восприимчивый штамм Harlan | Менее эффективны | |
| 2007 | Дельтаметринa | SC | США: Цинциннати, Огайо (CIN1, CIN2, CIN3); Лексингтон, Кентукки (LEX1) |
Устойчивый | >12 765 |
| 2007 | λ-цигалотринa | SC | США (Цинциннати, Огайо [CIN1]) | Устойчивый | >6123 |
| 2007 | Дельтаметринa | SC | США (Лос-Анджелес, Калифорния [LA2]; Киссимми, Флорида [KIS1]; Вена, Вирджиния [VIN1]) |
||
| 2007 | Дельтаметринa | SC | США (Лос-Анджелес, Калифорния [LA1]) | Восприимчивый | |
| 2008 | Дельтаметринa | SC | США (Нью-Йорк, штат Нью-Йорк [NY-BB]) | Устойчивый | >250 |
| 2008 | бифентринa | SC | США (Арканзас: Вашингтон, Кэрролл, Лафайет) | Восприимчивый | |
| 2008 | λ-цигалотринa | SC | США (Арканзас: Вашингтон, Кэрролл, Лафайет) | Восприимчивый | |
| 2008 | Перметринa | SC | США (Арканзас: Вашингтон, Кэрролл, Лафайет) | Восприимчивый | |
| 2008 | Карбарилb | SC | США (Арканзас: Вашингтон, Кэрролл, Лафайет) | Восприимчивый | |
| 2008 | Имидаклопридc | SC | США (Арканзас: Вашингтон, Кэрролл, Лафайет) | Восприимчивый | |
| 2008 | Фипронилd | SC | США (Арканзас: Вашингтон, Кэрролл, Лафайет) | Восприимчивый | |
| 2008 | Диазинонe | SC | США (Арканзас: Вашингтон, Лафайет) | Восприимчивый | |
| 2008 | Диазинонe | SC | США (Арканзас: Кэрролл) | Устойчивый | — |
| 2008 | Дихлофосe | SC | США (Арканзас: Вашингтон, Кэрролл, Лафайет) | Устойчивый | — |
| 2008 | Спиносадf | SC | США (Арканзас: Вашингтон, Кэрролл, Лафайет) | Устойчивый | — |
| 2008 | Хлорфенапирg | SC | США (Арканзас: Вашингтон, Кэрролл, Лафайет) | Менее эффективны | |
| 2008 | ДДТh | SC | США (Арканзас: Вашингтон, Кэрролл, Лафайет) | Устойчивый | — |
| 2008 | Хлорфенапирg | SC | США (Цинциннати, Огайо) | Менее эффективны | |
| 2009 | Пиримфос-метилe | T | Австралия (сиднейский штамм) | Восприимчивый | 2,6 |
| 2009 | Имидаклопридc | T | Австралия (сиднейский штамм) | Восприимчивый | 2,6 |
| 2009 | Бендиокарби | T | Австралия (сиднейский штамм) | Устойчивый | 250 |
| 2009 | Дельтаметринa | T | Австралия (сиднейский штамм) | Устойчивый | 370 000 |
| 2009 | Перметринa | T | Австралия (сиднейский штамм) | Устойчивый | 1 235 000 |
| 2009 | Диазинонe | T/SC | Австралия (сиднейский штамм) | Эффективный | |
| 2009 | Пиретриныa | T/SC | Австралия (сиднейский штамм) | Устойчивый | — |
| 2009 | β-цифлутринa | T/SC | Австралия (сиднейский штамм) | Устойчивый | — |
| 2009 | Тетраметринa | T/SC | Австралия (сиднейский штамм) | Устойчивый | — |
| 2009 | Дельтаметринa | SC | США (Цинциннати, Огайо [CIN-1]) | Устойчивый | >2588 |
| 2009 | Дельтаметринa | SC | США (Вустер, Массачусетс [WOR-1]) | Устойчивый | >2588 |
| 2010 | Дельтаметринa | SC | США (Нью-Йорк, штат Нью-Йорк) | Устойчивый | >9375 |
| 2010 | λ-цигалотринa | SC | США (Нью-Йорк, штат Нью-Йорк) | Устойчивый | 6990 |
| 2010 | Хлорфенапирg | SC | США (Цинциннати, Огайо [CIN-1]) | Эффективный | — |
| 2010 | Хлорфенапирg | SC | США (Вустер, Массачусетс [WOR-1]) | Эффективный | — |
| 2010 | Фенотринa | SC/T | Япония (4 полевых штамма) | Устойчивый | — |
| 2010 | Перметринa | SC/T | Япония (4 полевых штамма) | Устойчивый | — |
| 2010 | Дихлофосe | SC/T | Япония (4 полевых штамма) | Восприимчивый | |
| 2010 | Фенитротионe | SC/T | Япония (4 полевых штамма) | Восприимчивый | |
| 2010 | Пропоксурb | SC/T | Япония (4 полевых штамма) | Восприимчивый | |
| 2010 | Дельтаметринa | SC | США (Цинциннати, Огайо; Лексингтон, Кентукки; Трой, Мичиган; Довер, Нью-Джерси; Франкфорт, Кентукки; Каламазу, Мичиган; Вустер, Массачусетс; Смиттаун, Плейнвью, Нью-Йорк, Нью-Йорк) | Устойчивый | — |
| 2011 | Дельтаметринa | IT | США (Ричмонд, Вирджиния) | Устойчивый | 5167 |
| 2011 | β-цифутринa | IT | США (Ричмонд, Вирджиния) | Устойчивый | 111 |
| 2011 | Дельтаметринa | SC | США (Ричмонд, Вирджиния) | Устойчивый | 390,5 |
| 2011 | Дельтаметринa | SC | США (Цинциннати, Огайо) | Устойчивый | >340 |
| 2011 | Дельтаметринa | SC | США (Арлингтон, Вирджиния: Крамер) | Устойчивый | 339,6 |
| 2011 | Перметринa | SC | США (Арлингтон, Вирджиния: Крамер) | Устойчивый | >115,1 |
| 2011 | Дельтаметринa | SC | США (Ричмонд, Вирджиния) | Устойчивый | 390,5 |
| 2011 | Перметринa | SC | США (Ричмонд, Вирджиния) | Устойчивый | >291,7 |
| 2011 | ДДТh | SC | Таиланд (Чиангмай) | Устойчивый | — |
| 2011 | Дильдринh | SC | Таиланд (Чиангмай) | Устойчивый | — |
| 2011 | Бендиокарбb | SC | Таиланд (Чиангмай) | Устойчивый | — |
| 2011 | Пропоксурb | SC | Таиланд (Чиангмай) | Устойчивый | — |
| 2011 | Малатионe | SC | Таиланд (Чиангмай) | Устойчивый | — |
| 2011 | Фенитротионe | SC | Таиланд (Чиангмай) | Устойчивый | — |
| 2011 | Цифлутринa | SC | Таиланд (Чиангмай) | Устойчивый | — |
| 2011 | Дельтаметринa | SC | Таиланд (Чиангмай) | Устойчивый | — |
| 2011 | Перметринa | SC | Таиланд (Чиангмай) | Устойчивый | — |
| 2011 | β-цигалотринa | SC | Таиланд (Чиангмай) | Устойчивый | — |
| 2011 | Этофенпроксa | SC | Таиланд (Чиангмай) | Устойчивый | — |
| 2011 | Диазинонe | Spray | Таиланд (Чиангмай) | Менее эффективны | — |
| 2011 | Фенобукарбb | Spray | Таиланд (Чиангмай) | Менее эффективны | — |
| 2011 | Эсфенвалератa | Spray | Таиланд (Чиангмай) | Менее эффективны | — |
| 2011 | Циперметринa | Spray | Таиланд (Чиангмай) | Менее эффективны | — |
| 2011 | Бифентринa | Spray | Таиланд (Чиангмай) | Менее эффективны | — |
| 2011 | Хлорфенапирg | Spray | Таиланд (Чиангмай) | Менее эффективны | — |
| 2011 | Фипронилd | Spray | Таиланд (Чиангмай) | Менее эффективны | — |
| 2011 | Имидаклопридc | Spray | Таиланд (Чиангмай) | Эффективный | — |
| 2011 | Перметринa | T/SC | Дания | Устойчивый | — |
| 2011 | Дельтаметринa | SC | Дания | Устойчивый | — |
| 2011 | Хлорпирифосe | T/SC | Дания | Эффективный | — |
| 2012 | Дельтаметринa | SC | США (Колумбус, Огайо) | Устойчивый | — |
| 2012 | Пиретриныa | T | США (Нью-Хейвен, Коннектикут) | Устойчивый | — |
| 2012 | Цифлутринa | T | США (Нью-Хейвен, Коннектикут) | Устойчивый | — |
| 2012 | λ-цигалотринa | T | США (Нью-Хейвен, Коннектикут) | Устойчивый | — |
| 2012 | цис-циперметринa | T | США (Нью-Хейвен, Коннектикут) | Устойчивый | — |
| 2012 | Дельтаметринa | T | США (Нью-Хейвен, Коннектикут) | Устойчивый | — |
| 2012 | Дельтаметринa | T | США (Цинциннати, Огайо [CIN-1], Плейнвью, Нью-Йорк [NY-1]) | Устойчивый | — |
| 2012 | Неопинаминa | SC | Франция (Париж) | Устойчивый | — |
| 2012 | Сумитринa | SC | Франция (Париж) | Устойчивый | — |
| 2013 | Дельтаметринa | SC | США (CIN-1) | Устойчивый | 51 |
| 2013 | Дельтаметринa | SC | США (CIN-1 S) | Устойчивый | 32 700 000 |
| 2013 | Дельтаметринa | SC | США (Нью-Йорк-1) | Устойчивый | >300 |
| 2013 | Дельтаметринa | T | США (Ричмонд, Вирджиния) | Устойчивый | >200 000 |
| 2013 | β-цифутринa | T | США (Ричмонд, Вирджиния) | Устойчивый | >160 000 |
| 2014 | Дельтаметринa | SC | Германия (Берлин) | Устойчивый | 3,8–5,1 |
| 2014 | Дельтаметринa | SC | США: Нью-Йорк (Бруклин) | Восприимчивый | — |
| 2015 | Имидаклопридc β-цифлутринc |
SC | США (штаммы Richmond и Epic Center) | Устойчивый | E: 3–5; FI: 121–493 |
| 2015 | Ацетамипридc Бифентринa |
SC | США (штаммы Richmond и Epic Center) | Устойчивый | E: 39–1080; FI: 99–1943 |
| 2015 | Дельтаметринa | SC | США (штамм Epic Center) | Устойчивый | 392 |
| 2015 | d-аллетринa | SC | Австралия [Новый Южный Уэльс: Сидней (Абботсфорд, Дарлингхерст, Северная Парраматта, Нортбридж, Редферн), Ньюкасл (Мэриленд); ВИК: Мельбурн (Риппонлеа, Саут-Ярра, Муни-Пондс), Западный Мельбурн; Западная Америка: Перт (Коттесло); NT: Алис-Спрингс; ЮАР: Аделаида (Парк Семафор)] | Устойчивый | — |
| 2016 | Имидаклопридc | T | США (Джерси-Сити, Нью-Джерси) | Восприимчивый | 2.0 |
| 2016 | Имидаклопридc | T | США (Троя, Мичиган) | Устойчивый | 462,6 |
| 2016 | Имидаклопридc | T | США (Цинциннати, Огайо) | Устойчивый | 163,3 |
| 2016 | Ацетамипридc | T | США (Джерси-Сити, Нью-Джерси) | Устойчивый | 31,7 |
| 2016 | Ацетамипридc | T | США (Троя, Мичиган) | Устойчивый | >33 333 |
| 2016 | Ацетамипридc | T | США (Цинциннати, Огайо) | Устойчивый | >33 333 |
| 2016 | Тиаметоксамc | T | США (Джерси-Сити, Нью-Джерси) | Восприимчивый | 2,4 |
| 2016 | Тиаметоксамc | T | США (Троя, Мичиган) | Устойчивый | 546 |
| 2016 | Тиаметоксамc | T | США (Цинциннати, Огайо) | Устойчивый | 226,2 |
| 2016 | Динотефуранc | T | США (Джерси-Сити, Нью-Джерси) | Устойчивый | 46,8 |
| 2016 | Динотефуранc | T | США (Троя, Мичиган) | Устойчивый | 198 |
| 2016 | Динотефуранc | T | США (Цинциннати, Огайо) | Устойчивый | 358,6 |
| 2016 | Дельтаметринa | T | Австралия: Парраматта (Новый Южный Уэльс), Алис-Спрингс (Северная Каролина) и Мельбурн (Виктория). | Устойчивый | — |
| 2016 | Дельтаметринa | SC | Австралия (Парраматта [Новый Южный Уэльс]) | Устойчивый | — |
| C. hemipterus | |||||
| 2002 | α-циперметринa | SC | Танзания | Устойчивый | — |
| 2002 | Перметринa | SC | Танзания | Устойчивый | — |
| 2007 | ДДТh | SC | Шри-Ланка | Устойчивый | — |
| 2007 | Малатионe | SC | Шри-Ланка | Устойчивый | — |
| 2007 | Пропоксурb | SC | Шри-Ланка | Устойчивый | — |
| 2007 | Дельтаметринe | SC | Шри-Ланка | Устойчивый | — |
| 2007 | Перметринe | SC | Шри-Ланка | Устойчивый | — |
| 2011 | λ-цигалотринa | SC | Малайзия (Кмелаю14); Сингапур (Серангун) | Эффективный | — |
| 2011 | Бифентринa | SC | Малайзия (Кмелаю14); Сингапур (Серангун) | Эффективный | — |
| 2011 | Фенитротионe | SC | Малайзия (Кмелаю14); Сингапур (Серангун) | Эффективный | — |
| 2011 | Фипронилd | SC | Малайзия (Кмелаю14); Сингапур (Серангун) | Эффективный | — |
| 2011 | Имидаклопридc | SC | Малайзия (Кмелаю14); Сингапур (Серангун) | Эффективный | — |
| 2011 | ДДТh | SC | Малайзия (Кмелаю14); Сингапур (Серангун) | Устойчивый | — |
| 2011 | ДДТh | SC | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Устойчивый | — |
| 2011 | Дильдринh | SC | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Устойчивый | — |
| 2011 | Бендиокарбb | SC | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Устойчивый | — |
| 2011 | Пропоксурb | SC | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Устойчивый | — |
| 2011 | Малатионe | SC | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Устойчивый | — |
| 2011 | Фенитротионe | SC | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Устойчивый | — |
| 2011 | Цифлутринa | SC | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Устойчивый | — |
| 2011 | Дельтаметринa | SC | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Устойчивый | — |
| 2011 | Перметринa | SC | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Устойчивый | — |
| 2011 | λ-цигалотринa | SC | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Устойчивый | — |
| 2011 | Этофенпроксa | SC | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Устойчивый | — |
| 2011 | Диазинонe | Spray | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Менее эффективны | — |
| 2011 | Фенобукарбb | Spray | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Менее эффективны | — |
| 2011 | Эсфенвалератa | Spray | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Менее эффективны | — |
| 2011 | Циперметринa | Spray | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Менее эффективны | — |
| 2011 | Бифентринa | Spray | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Менее эффективны | — |
| 2011 | Хлорфенапирg | Spray | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Менее эффективны | — |
| 2011 | Фипронилd | Spray | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Менее эффективны | — |
| 2011 | Имидаклопридc | Spray | Таиланд (Бангкок, Чонбури, Пхукет, Краби) | Эффективный | — |
| 2015 | d-аллетринa | SC | Австралия (Северный Квинсленд) | Устойчивый | >130 |
| 2015 | d-аллетринa | SC | Австралия (Сидней, [Новый Южный Уэльс]: Оберн) | Устойчивый | 37 |
| 2015 | d-аллетринa | SC | Малайзия (Куала-Лумпур) | Устойчивый | >130 |
| 2015 | d-аллетринa | SC | Таиланд (Бангкок, Чиангмай) | Устойчивый | >130 |
| 2015 | d-аллетринa | SC | Африка (Кения) | Устойчивый | 30 |
SC — поверхностный контакт
T — местное применение
IT — инъекция
Spray — Спрей
—
a — Пиретроиды
b — Карбаматы
c — Неоникотиноиды
d — Фенилпиразолы
e — Органофосфаты
f — Спиносин
g — Пиррол
h — Хлорированные углеводороды
Устойчивость клопов к неоникотиноидам
Имидаклоприд (неоникотиноиды) был представлен на рынке в 1991 году. Неоникотиноиды в настоящее время широко используются против целого спектра грызущих и сосущих вредителей, включая постельных клопов. За последние несколько лет неоникотиноиды были объединены с пиретроидами в рецептурах препаратов, таких как:
- Temprid® SC (бета-цифлутрин + имидаклоприд);
- Transport® Mikron (бифентрин + ацетамиприд);
- Tandem® (лямбда-цигалотрин + тиаметоксам).
Также неоникотиноиды соединяли и с диатомовой землей (инсектицидом альпийской пыли с динотефураном) для борьбы с постельными клопами. Однако в недавнем исследовании C. Lectularius собранные из жилищ человека в Цинциннати и Мичигане, США, показали умеренный или высокий уровень толерантности/резистентности к различным неоникотиноидам. Ученые Romero & Anderson сообщили, что устойчивость к неоникотиноидам, вероятно, может быть обусловлена повышенной ферментативной активностью, обнаруженной в этих популяциях.
Эти результаты показывают, что толерантность или даже резистентность к неоникотиноидам в настоящее время присутствует в популяциях полевых клопов.
Эффективность пиррола в борьбе с постельными клопами
Помимо традиционных инсектицидов (пиретроидов, фосфорорганических соединений и карбаматов), также оценивались новые инсектициды, такие как хлорфенапир из класса пирролов. Пирролы представляют собой класс проинсектицидов, которые активируются монооксигеназами цитохрома Р450 до более активного метаболита. В отличие от нейротоксичных инсектицидов (пиретроидов), пирролы являются митохондриальными ингибиторами транспорта электронов (METI), которые нарушают превращение аденозиндифосфата (АДФ) в аденозинтрифосфат (АТФ) (окислительное фосфорилирование) в митохондриях клеток. Результатом этого процесса является потеря выработки энергии, что приводит к дисфункции клеток и последующей гибели организма.
Благодаря своему новому способу действия пирролы (хлорфенапир) в настоящее время зарегистрированы более чем в 19 странах для борьбы с различными насекомыми и клещами-вредителями, особенно против устойчивых к пиретроидам насекомых-вредителей, включая постельных клопов. Тем не менее, появляется все больше сообщений о том, что клопы и клещи становятся резистентными или перекрестно-резистентными к пирролам, в основном из-за метаболической резистентности (P450s и эстераз).
Несмотря на то, что до сих пор не было зарегистрировано случаев устойчивости к хлорфенапиру у постельных клопов, это соединение показало различную эффективность против насекомых. В то время как хлорфенапир (Фантом®) действовал чрезвычайно медленно в лабораторных остаточных биоанализах, прямое нанесение препарата на стены зараженных квартир привело к снижению численности постельных клопов на 61% всего за 3 дня. Исследователь Ромеро и другие сообщили, что хлорфенапир является нерепеллентным инсектицидом с длительной остаточной активностью против C. lectularius на основании лабораторных исследований. Напротив, другие ученые обнаружили низкую эффективность этого вещества даже в отношении восприимчивых лабораторных постельных клопов. В ходе полевых испытаний Phantom® широко распылялся в 15 квартирах ежемесячно в течение 5 месяцев. Исследователи добились полного уничтожения постельных клопов только на 12 объектах, несмотря на использование ряда нехимических средств, однако три объекта остались зараженными. Невозможно определить, было ли это связано с низкой эффективностью средства (и возможной устойчивостью) или с повторным появлением постельных клопов.
Устойчивость клопов к другим инсектицидам
Помимо устойчивости к ДДТ, к 1950-м годам оба вида постельных клопов также развили устойчивость к:
- другим хлорированным углеводородным соединениям:
- gamma-HCH — гамма-гексахлорциклогексану (1957);
- метоксихлору (1958);
- дильдрину (1958);
- альдрину (1958);
- эндрину (1958).
- органофосфаты (ФОС):
- малатион (1971);
- карбарил (карбамат) (1972).
После возрождения в новом тысячелетии устойчивость к OCs (хлорорганические соединения), OPs (фосфорорганические соединения) и карбаматам также была зарегистрирована у постельных клопов (таблица.4). Все эти классы инсектицидов в значительной степени запрещены для использования внутри помещений против постельных клопов, за исключением отдельных стран Азии, Африки и некоторых стран Латинской Америки.
Механизмы сопротивления постельных клопов
Устойчивость к инсектицидам можно разделить на два основных типа: поведенческая и физиологическая. При поведенческой резистентности популяции насекомых могут развить способность избегать или снижать летальное воздействие инсектицидов. Физиологическая резистентность относится к механизмам физиологической модификации, включая снижение проникновения кутикулы, усиление метаболической детоксикации и снижение чувствительности участка-мишени. Поведенческая и физиологическая устойчивость часто сосуществуют у насекомых-вредителей, и обе формы могут быть связаны с устойчивостью постельных клопов (таблица 3, рис. 8). Здесь обсуждаются механизмы устойчивости у постельных клопов, а также возможные механизмы невосприимчивости, которые еще предстоит подтвердить. До сих пор только устойчивость к проникновению, метаболическая резистентность (а именно, P450s и эстераза) и нечувствительность к участку-мишени (а именно, kdr мутиции) придают постельным клопам устойчивость. Другие механизмы резистентности, которые еще предстоит обнаружить у постельных клопов, включают поведенческую устойчивость, глутатион-S-трансферазу (GST), измененную ацетилхолинэстеразу (AChEs), нечувствительный рецептор γ-аминомасляной кислоты (GABA), измененные nAChR и симбионт-опосредованную устойчивость к инсектицидам.
Далее обсудим роль транспортеров АТФ-связывающих (АВС) в усилении удаления токсикантов из целевого участка. Для простоты обсуждения мы обсудим механизмы устойчивости в соответствии с типами (поведенческие, метаболические, нечувствительность к месту-мишени и т.д.) и выделим механизмы резистентности, которые еще предстоит обнаружить у постельных клопов в качестве механизмов-кандидатов.
Таблица 3. Подтвержденные и предполагаемые механизмы резистентности у постельных клопов
| Механизм | C. lectularius | C. hemipterus | Инсектицид | ||
| Поведенческое сопротивление | Механизм-кандидат | Механизм-кандидат | Пиретроиды | ||
| Физиологическое сопротивление | Сопротивление проникновению | Кутикула | Подтверждено морфологическим исследованием | Механизм-кандидат | Широкий спектр классов инсектицидов |
| Метаболическая резистентность | P450s | Подтверждено исследованиями РНК-интерференции и синергизма | Подтверждено исследованиями синергизма | Пиретроиды, ХОС, ФОС, карбаматы, неоникотиноиды и пирролы | |
| Эстеразы | Подтверждено исследованиями синергизма | Механизм-кандидат | Карбаматы, ФОС, пирролы, неоникотиноиды и пиретроиды | ||
| GSTs | Механизм-кандидат | Механизм-кандидат | ХОС, ФОС и пиретроиды | ||
| ABC-транспортеры | Проверено РНКи | Механизм-кандидат | Пиретроиды, ХОС, ФОС, карбаматы и неоникотиноиды | ||
| Нечувствительность целевого участка | kdr | Проверено QS в сочетании с FCVB | Механизм-кандидат | Пиретроиды и ДДТ | |
| Измененные AChE | Механизм-кандидат | Механизм-кандидат | ФОС и карбаматы | ||
| Нечувствительные ГАМК-рецепторы | Механизм-кандидат | Механизм-кандидат | Циклодиены (OCs) и фенилпиразолы | ||
| Измененные nAChRs | Механизм-кандидат | Механизм-кандидат | OPs | ||
ХОС (OCs) — хлорорганические соединения
ФОС (OPs) — фосфорорганические соединения
ДДТ (DDT) — дихлордифенилтрихлорэтан
AChE — ацетилхолинэстераза
nAChRs — никотиновые ацетилхолиновые рецепторы
Рис. 8 Схема потенциальных поведенческих и физиологических изменений, связанных с устойчивостью к инсектицидам у постельных клопов.
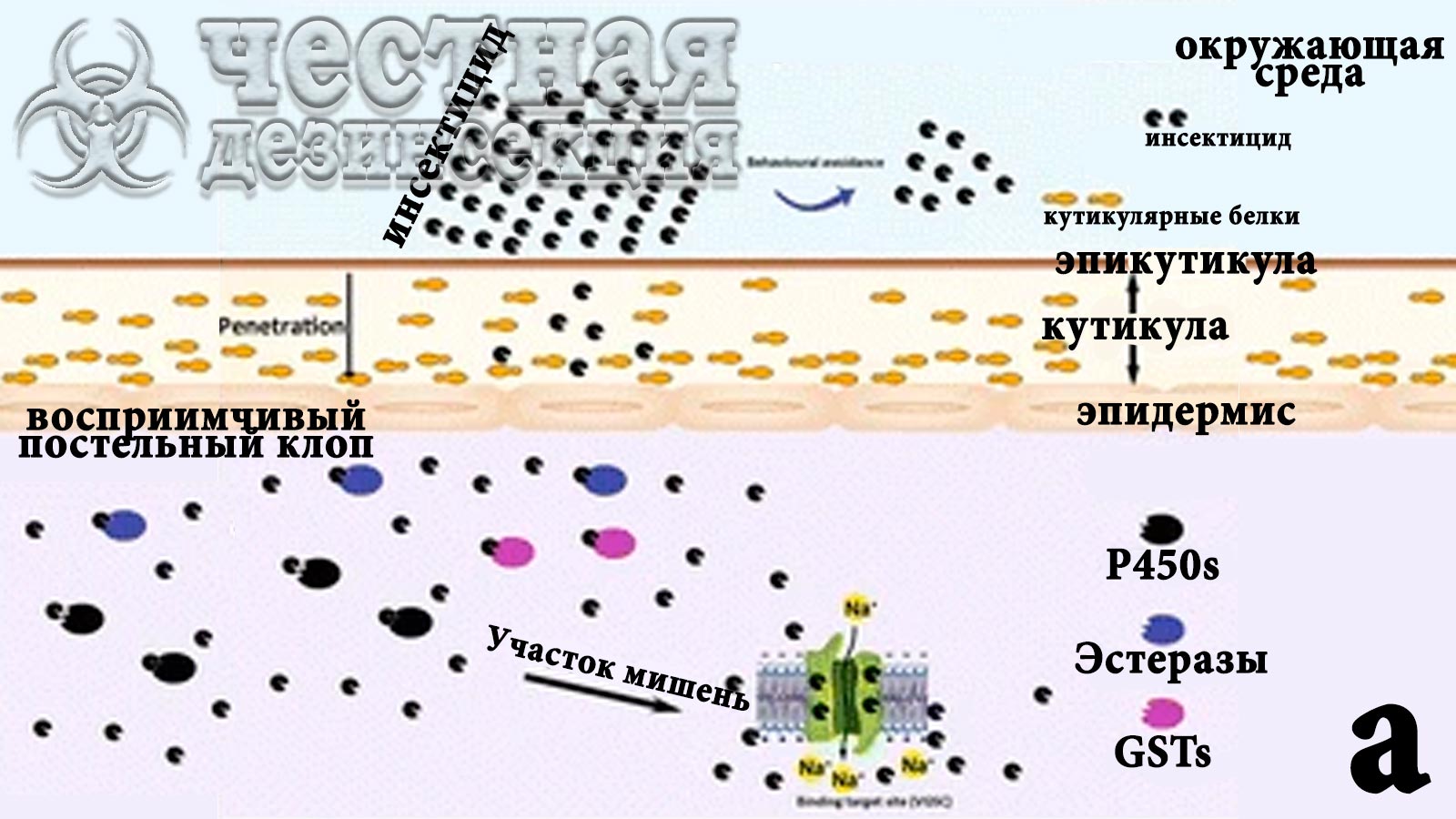
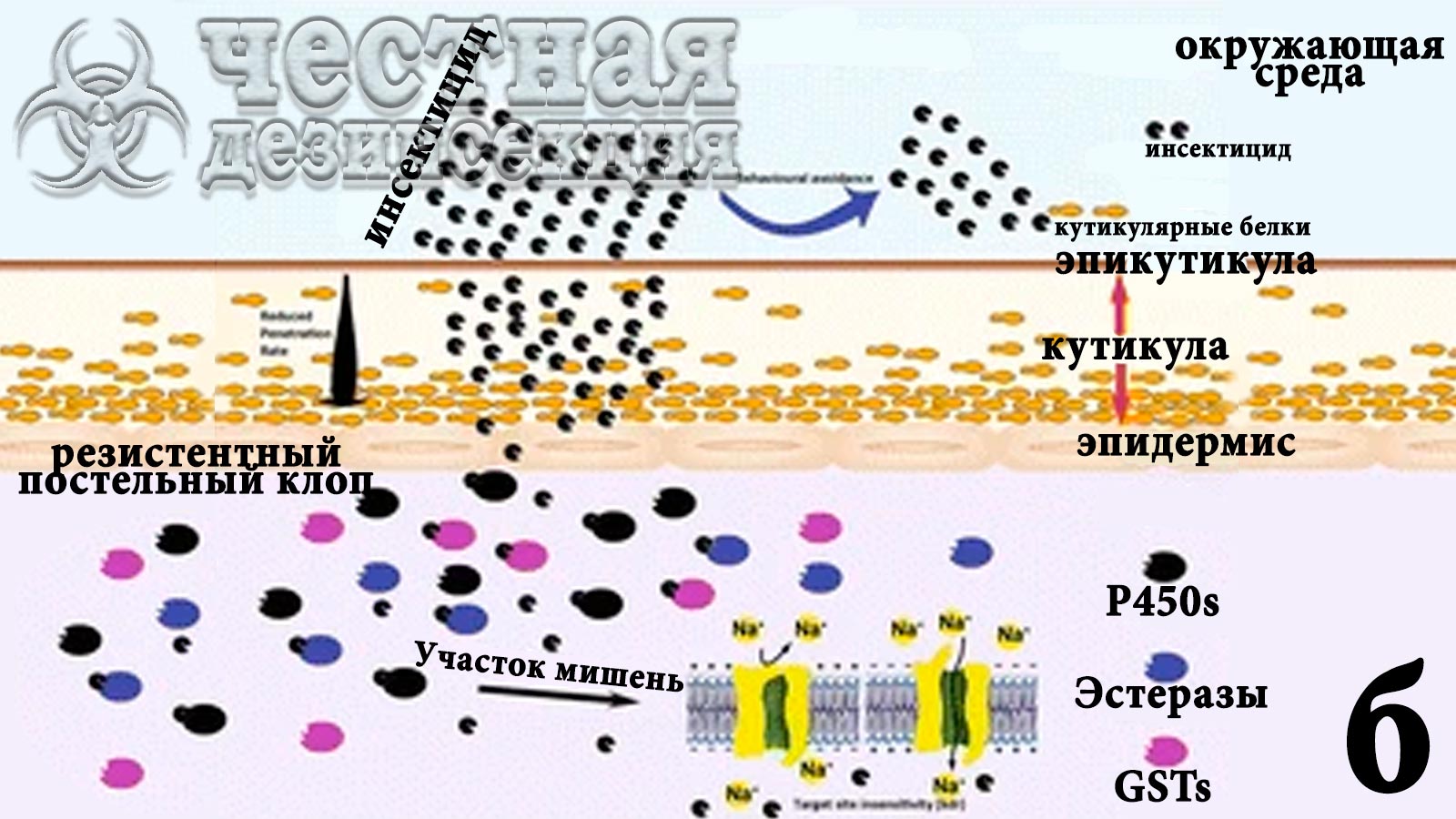
Различные формы резистентности действуют в комбинированных слоях, противодействуя действию инсектицида. Например, прямое применение инсектицида, такого как пиретроид, может убить постельных клопов; однако из-за «возбуждающей репеллентности» этого класса соединений некоторые постельные клопы могут избегать воздействия инсектицидов (потенциальная поведенческая устойчивость). Если постельные клопы вступают в контакт с инсектицидом, хитиновое покрытие тельца может быть утолщено или реконструировано за счет чрезмерной экспрессии кутикулярных белков, что снизит скорость проникновения инсектицида (сопротивление проникновению) за пределы кутикулярного слоя. Если инсектициды попадают внутрь насекомого, постельные клопы могут усиливать метаболическую детоксикацию (P450s, эстеразы, GSTs – глутатион S-трансфераза) для подавления инсектицидного эффекта (метаболическая резистентность). kdr мутации могут снизить чувствительность целевого участка к инсектициду (нечувствительность целевого участка).
Поведенческое сопротивление – предполагаемый механизм
Поведенческое сопротивление можно разделить на две широкие категории:
- стимул-зависимое поведение (раздражительность и отталкивание);
- стимул-независимое поведение (экзофилия, отдых вне зоны обработки).
Стимул-зависимое поведение требует сенсорной стимуляции насекомого для обнаружения поверхности, обработанной токсином, до получения летальной дозы, при которой токсикант вызывает реакцию избегания. Такое поведение наблюдалось у ряда насекомых-вредителей. Наиболее известным примером является отвращение к глюкозе приманки у прусаков, Blattella germanica (L.), который был отобран в результате полевого воздействия коммерческих приманок для тараканов. И наоборот, поведение, независящее от стимула, относится к поведению насекомых, которое предотвращает воздействие токсиканта на них. Такое поведение не требует сенсорной стимуляции токсикантом для того, чтобы произошло избегание. Одним из примеров является «экзофилия», которая относится к изменениям поведения комаров-анофелинов (Culicidae Anopheles) от их обычной привычки кусать в помещении к укусам на открытом воздухе. Такое поведение снижает распространенность комаров в помещении и, следовательно, снижает вероятность контакта комаров с инсектицидами внутри помещений.
Хотя поведенческая устойчивость была зарегистрирована у многих групп насекомых-вредителей, она никогда не изучалась должным образом и не подтверждалась у постельных клопов. Было проведено несколько исследований, в которых сообщалось о некоторых наблюдениях за поведением постельных клопов в присутствии инсектицидов. Одно недавнее исследование показало, что чувствительные и устойчивые к инсектицидам C. lectularius могут либо избегать остановок на фильтровальной бумаге, обработанной дельтаметрином, либо ускорять свое движение при прямом контакте с сублетальными дозами дельтаметрина. Возможно, это предполагало эксито-репеллентность, форму поведенческого сопротивления. Однако в другом исследовании ученые Мур и Миллер обнаружили, что чувствительные и устойчивые к инсектицидам особи C. Lectularius не избегали поверхностей, обработанных лямбда-цигалотрином. Cimex lectularius также не избегал воздействия хлорфенапира. Постельные клопы очень скрытны и часто прячутся в темных местах, трещинах и щелях. Эта уникальная поведенческая характеристика может защитить их от контакта с инсектицидами на обработанных поверхностях.
Физиологическое сопротивление постельных клопов
В отличие от поведенческой резистентности многие исследования выявили физиологические механизмы резистентности у постельных клопов (таблица 1). Mamidala Praveen (Professor Telangana University Department of Biotechnology) недавно обнаружил, что метаболическая детоксикация, кутикулярные белки и мутации устойчивости к нокдауну (kdr) связаны с устойчивостью к инсектицидам у C. lectularius. Точно так же Fang Zhu (Assistant Professor of Entomology) сообщила о наличии мутаций kdr и/или дифференциальной экспрессии генов, включая метаболические гены (P450s, эстеразы, транспортеры ABC) и гены кутикулярных белков, связанные с устойчивостью к инсектицидам (резистентность к пиретроидам) у C. lectularius. В целом, были исследованы три основных физиологических механизма устойчивости постельных клопов к инсектицидам, а именно устойчивость к проникновению, метаболическая устойчивость и нечувствительность к месту-мишени.
Сопротивление клопов проникновению опасных веществ
Контактные инсектициды должны пройти через кутикулу насекомого, прежде чем достигнуть целевого участка. Поэтому кутикула служит первой линией защиты от инсектицидов. Устойчивые насекомые вырабатывают кутикулярные барьеры, развивая более толстую кутикулу или изменяя структуру кутикулы, чтобы снизить скорость проникновения инсектицидов в тело насекомого. Устойчивость к проникновению может обеспечивать защиту насекомых от различных классов инсектицидов. Устойчивость к проникновению также работает в сочетании с другим механизмом (механизмами) устойчивости, поскольку было высказано предположение, что снижение проникновения кутикулы может помочь «выиграть больше времени» для выработки ферментов детоксикации для метаболизма инсектицида или позволить насекомому выделить инсектицид до того, как он достигнет цель. Сообщалось о резистентности к проникновению у различных насекомых-вредителей, включая комнатных мух Musca domestica (L.), прусаков B. germanica, комаров денге Aedes aegypti (L.), и обычных постельных клопов, C. lectularius.
Устойчивость к проникновению играет решающую роль в невосприимчивости постельных клопов к инсектицидам. Koganemaru R. продемонстрировали, что коэффициент устойчивости у резистентного штамма Richmond C. lectularius , который местно наносили с дельтаметрином или бета-цифлутрином на кутикулу, был в 105 выше, чем при подкожном нанесении, по сравнению с чувствительным к инсектицидам штаммом Harlan. Однако по сравнению с другими физиологическими механизмами резистентности устойчивость к проникновению остается наименее изученной для многих насекомых-вредителей. Тем не менее, в последнее время были предприняты различные попытки секвенирования РНК и генома для идентификации предполагаемых генов, связанных с устойчивостью к проникновению через кутикулу у постельных клопов. Bai X и другие ученые проанализировали с помощью метода 454-пиросеквенирования транскриптомные последовательности C. lectularius из восприимчивого штамма Harlan и одного резистентного штамма, собранного в полевых условиях, и идентифицировали 45 предполагаемых генов кутикулярных белков, которые, возможно, были связаны с устойчивостью к инсектицидам у постельных клопов. Mamidala P и другие обнаружили 46 генов кутикулярных белков, которые были активированы в устойчивых к дельтаметрину особях C. lectularius. Пять генов кутикулярных белков:
- белок кутикулы личинки (LCP);
- белок кутикулы куколки (PCP);
- хитинсинтаза (CHS);
- хитиндеацетилаза (CDA);
- кутикулярный белок, аналог перитрофина (CPAP).
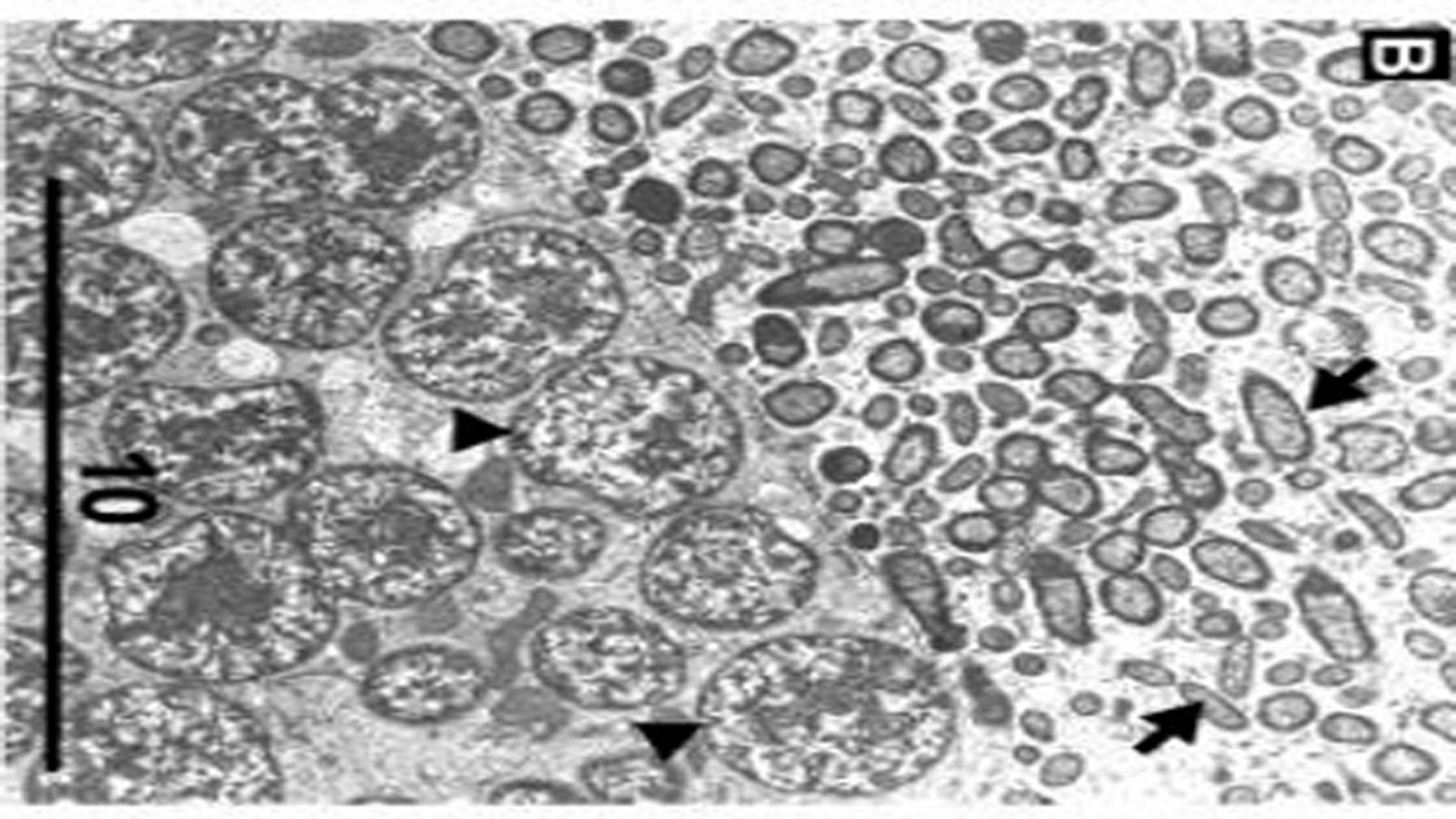
были дополнительно подтверждены количественной ПЦР в реальном времени. (qRT-PCR) возможно связано с устойчивостью к инсектицидам C. Lectularius. Эти гены демонстрировали более высокие уровни транскриптов у устойчивых штаммов по сравнению с таковыми у восприимчивых штаммов. Аналогичным образом сообщалось, что еще 19 генов кутикулярных белков связаны с устойчивостью к инсектицидам у Cimex lectularius , особенно с невосприимчивостью к пиретроидам. Предполагается, что сверхэкспрессия этих генов приводит к утолщению или ремоделированию кутикулы постельного клопа для снижения скорости проникновения инсектицида, что может предотвратить или замедлить проникновение инсектицида в целевые участки нервных клеток (рис. 8б). Эти результаты свидетельствуют о том, что устойчивость к проникновению вносит значительный вклад в невосприимчивость постельных клопов к инсектицидам. К сожалению, до сих пор не сообщалось об исследованиях устойчивости Cimex hemipterus к проникновению.
Молекулярные анализы, такие как метод dsRNA-опосредованной интерференции (RNAi), возможно, не в состоянии подтвердить связь между сверхэкспрессией культикулярных генов и устойчивостью к проникновению, поскольку кутикула утолщена или реконструирована. Тем не менее, недавнее исследование, изучающее взаимосвязь между толщиной кутикулы C. lectularius и остаточными биоанализами инсектицидов, выявило положительную корреляцию между утолщенной кутикулой и уровнем устойчивости к инсектицидам. Авторы обнаружили, что высокорезистентные к пиретроидам особи штамма Parramatta C. lectularius обладали значительно более толстой кутикулой по сравнению с кутикулой чувствительного к инсектицидам штамма. Кроме того, толщина кутикулы этого резистентного штамма положительно коррелировала со временем нокдауна в биотестах на инсектициды. Будущие исследования должны быть выполнены для получения прямых доказательств устойчивости постельных клопов к проникновению посредством цефалометрического анализа invivo с использованием инсектицида, меченного радиоактивным изотопом.
Метаболическая резистентность клопов
Метаболическая резистентность считается ключевым механизмом устойчивости. Основываясь на обзоре метаболической резистентности постельных клопов исследователем Мамидала и других ученых, делаем вывод что, три основные группы ферментов, а именно P450s, эстеразы и GSTs, а также транспортеры ABC, вовлечены (таблица 3) и могут иметь широкий спектр активности против различных классов инсектицидов. К сожалению, большая часть исследований метаболической резистентности проводилась на Cimex lectularius; исследования метаболической резистентности у Cimex hemipterus ограничены (таблица 3).
Влияние цитохром P450 монооксигеназы на устойчивость клопов
P450s – самое важное подмножество монооксигеназной системы, составляют одно из крупнейших надсемейств белков, обнаруженных во всех живых организмах, и играют важную роль в детоксикации инсектицидов. Недавно было охарактеризовано более 1700 генов Р450s различных насекомых, а у насекомых-гематофагов было обнаружено 386 контигов Р450s, ассоциированных с устойчивостью к инсектицидам.
Существует два возможных механизма, приписываемых повышающей регуляции генов P450:
- конститутивная сверхэкспрессия транскрипции (уровни мРНК), при которой ген непрерывно транскрибируется;
- индуцированная сверхэкспрессия транскрипции, при которой экспрессия ген индуцируется по мере необходимости.
Однако факторы, регулирующие сверхэкспрессию P450 в этих двух механизмах, менее известны. Первый механизм распространен у многих насекомых-вредителей, в том числе и у постельных клопов. В настоящее время связь между устойчивостью к инсектицидам и конститутивной сверхэкспрессией генов Р450 показана у C. lectularius. Адельман и др. обнаружили, что коэффициенты устойчивости к дельтаметрину и β-цифлутрину у C. lectularius (штамм Richmond по сравнению с восприимчивым штаммом Harlan) составляли 5167 и 111 соответственно. Биохимические анализы показали, что активность P450 штамма Richmond была значительно повышена на 41% по сравнению с активностью штамма Harlan. Кроме того, генетические исследования показали, что три гена P450, а именно CYP397A1 (>36 раз), CYP6DM2 (>29 раз) и CYP400A1 (>18 раз), были значительно сверхэкспрессированы в штамме Richmond. Штамм Richmond показал высокую устойчивость к пиретроидам из-за сверхэкспрессии генов P450 (а также возможных других механизмов). Кроме того, четыре P450 гена (CYP9, CYP397A1V2, CYP6A2 и CYP6A13) предположительно ответственны за устойчивость C. lectularius к пиретроидам. Метод опосредованной дцРНК интерференции (РНКи) подтвердил, что еще четыре гена P450 (CYP397A1, CYP398A1, CYP6DN1 and CYP4CM1) вовлечены в устойчивость C. lectularius к пиретроидам, поскольку эти гены активировались в резистентных штаммах. Исследования молекулярной стыковки показали, что гены P450 могут придавать перекрестную устойчивость к основным классам инсектицидов (хлорорганические соединения, пиретроиды и неоникотиноиды), используемыми для борьбы с постельными клопами. Все эти данные свидетельствуют о том, что детоксикация, опосредованная P450, играет ключевую роль в метаболической устойчивости к инсектицидам, особенно к пиретроидам.
Во втором механизме экспрессия некоторых генов P450 может индуцироваться экзогенными и эндогенными соединениями, включая инсектициды, что приводит к повышению устойчивости к инсектицидам. Это явление было зарегистрировано у нескольких насекомых-вредителей, включая M. domestica и комаров Culex quinquefasciatus. Кроме того, оба механизма (конститутивная и индуцированная сверхэкспрессия) могут проявляться в одной и той же популяции насекомых в пределах области, например, у M. domestica. Однако по сравнению с конститутивной сверхэкспрессией индукция, связанная с устойчивостью к инсектицидам, менее известна и до настоящего времени не описана у постельных клопов. Необходимо провести дальнейшие исследования, чтобы лучше понять механизм индукции постельных клопов.
В настоящее время смешанные инсектициды, содержащие неоникотиноиды и пиретроиды, используются для борьбы с постельными клопами. Конститутивная или как конститутивная, так и индуцированная гиперпрессия генов P450 была связана с устойчивостью к неоникотиноидам у других насекомых. В связи с устойчивостью к неоникотиноидам у C. Lectularius, необходимы дальнейшие исследования для определения роли P450s, а также потенциальной перекрестной устойчивости у обоих видов постельных клопов.
Реакция системы Р450 требует переноса электрона от никотинамидадениндинуклеотидфосфата (NADPH) к центру гема Р450 ферментом-партнером цитохрома Р450, НАДФН-цитохром Р450 редуктазой (CPR – NADPH-редуктаза цитохрома Р450) и/или цитохром b5 редуктазой в микросомальных системах, и адренодоксин-подобным ферредоксином, связанным с адренодоксинредуктазой в митохондриальных системах. Недавно Zhu и другие секвенировали и охарактеризовали ген CPR из C. lectularius (ClCPR) и обнаружили, что RNAi подавляет экспрессию ClCPR, что приводит к появлению устойчивого штамма CIN-1 (собранный в полевых условиях C. lectularius ) штамм, собранный в 2005 году в Цинциннати, штат Огайо), демонстрирующий повышенную чувствительность к дельтаметрину. Это открытие подтвердило, по крайней мере, частичную роль CPR в детоксикации, опосредованной P450, и показало, что у штамма CIN-1 возникает опосредованная P450 метаболическая устойчивость к пиретроидам.
Пиперонилбутоксид (ПБО), первичный ингибитор некоторых монооксигеназ цитохрома Р450, используется для характеристики возможного участия Р450-опосредованной детоксикации в качестве механизма резистентности. Пиперонилбутоксид может быть включен в рецептуры в качестве синергиста инсектицидов на основе пиретроидов для повышения их эффективности. Ромеро и др. использовали PBO (Piperonyl butoxide) для определения роли P450 в устойчивости к дельтаметрину у двух высокорезистентных C. lectularius штаммов (CIN-1: Цинциннати, Огайо, США; WOR-1, собран в 2007 г. в Вустере, Массачусетс, США). Результаты показали, что уровень резистентности CIN-1 и WOR-1 снизился с > 2588 раз до 174 раз и с > 2588 раз до 39 раз после применения пиперонилбутоксида, соответственно, по сравнению с соответствующими результатами, полученными с восприимчивым штаммом Fort Dix (Harlan). Эти результаты показали, что P450s частично способствуют устойчивости к дельтаметрину у этих штаммов C. lectularius. Аналогичные исследования синергизма были проведены How & Lee и Lilly для двух штаммов C. hemipterus из Юго-Восточной Азии и четырех штаммов C. lectularius из Австралии. Оба исследования подтвердили, что у постельных клопов возникает опосредованная Р450 метаболическая устойчивость к пиретроидам.
Роль эстеразы в невосприимчивости постельных клопов
Эстеразы придают устойчивость к карбаматам и ФОС (фосфорорганические соединения) у многих видов насекомых, а также к пиретроидам в основном за счет активности карбоксиэстераз, и только у нескольких редких случаях арилэстеразами (ароматические эстеразы).
Эстеразы (особенно карбоксиэстеразы) опосредуют метаболическую резистентность посредством двух основных механизмов:
- повышенный уровень экспрессии генов (количественные изменения);
- мутации в кодирующих последовательностях генов (качественные изменения).
В первом механизме (количественное изменение) резистентные насекомые перепроизводят неспецифические эстеразы или карбоксиэстеразы за счет активации генов, чтобы быстро изолировать инсектициды (карбаматы и ФОС). Этот механизм был задокументирован у многих видов насекомых, включая комаров, клещей крупного рогатого скота, тлей, тараканов, а также у C. hemipterus и C. lectularius. Адельман и др. недавно сообщили о значительном увеличении общей активности эстеразы (по крайней мере, на 35%), основанном на биохимических анализах, у высокорезистентного штамма Richmond C. lectularius по сравнению с восприимчивым штаммом Harlan. Их последующие выводы, основанные на генетических исследованиях (путем секвенирования РНК и относительной экспрессии генов на основе qRT-PCR), показали, что два гена, кодирующих эстеразу, CE3959 и CE21331, были значительно сверхэкспрессированы в штамме Richmond. Эти данные свидетельствуют о том, что CE3959 и CE21331 могут быть генами-кандидатами, способствующими опосредованной эстеразой резистентности у C. lectularius. Чжу и др. также обнаружили, что ген CLCE21331 (также известный как CE21331 ) был связан с устойчивостью к пиретроидам C. lectularius из-за сверхэкспрессии в устойчивых штаммах. Впоследствии они определили, что ген CLCE21331 демонстрировал максимальную активацию (более чем в 50 раз) в большинстве полевых популяций (76,2% из 21 популяции) по сравнению с восприимчивым штаммом LA-1 C. lectularius (собранным в 2006 г. в Лос-Анджелесе, Калифорния, США), что убедительно свидетельствует о важности опосредованной эстеразой метаболической резистентности у постельных клопов. Карунаратне и др. обнаружили, что механизмы повышенной эстеразы присутствуют у C. Hemipterus популяции, основанные на биохимических анализах, и повышенном уровне общих эстераз также были связаны с устойчивостью к неоникотиноидам у C. lectularius. Тем не менее, дальнейшие исследования, включая использование исследований метаболизма, должны быть предприняты для экспериментальной проверки специфического гена(ов), кодирующего механизм, опосредованный эстеразой, у постельных клопов. Помимо биохимических анализов и генетических исследований устойчивости, опосредованной эстеразой, исследователи также использовали биоанализы в сочетании с синергистами для изучения уровней активности общих эстераз в устойчивых популяциях постельных клопов. Хардстоун и др. выбрали PBH (3-феноксибензилгексаноат, суррогатный субстрат для карбоксиэстераз и оксидаз) в качестве метаболического синергиста для подавления устойчивости к пиретроидам у C. lectularius. Авторы обнаружили, что PBH синергизирует действие дельтаметрина в 6 раз на чувствительный к инсектицидам штамм C. lectularius (FL-BB, собранный в Гейнсвилле, штат Флорида, США, более 20 лет назад) и проявляет синергизм в 2,8 раза больше, чем ПБО. Эти данные свидетельствуют о том, что эстеразы участвуют в метаболической детоксикации дельтаметрина C. lectularius. Точно так же Лилли и соавторы использовали новый синергист EN16/5-1 (6-[2-(2-бутоксиэтокси)этоксиметил]-5-пропил-2, 3-дигидробензофуранби), который в основном ингибирует активность эстераз, чтобы определить, опосредовано ли эстеразой устойчивость к пиретроидам существует у C. lectularius . Они обнаружили, что устойчивость трех из четырех штаммов C. lectularius к дельтаметрину была значительно подавлена EN16/5-1, что убедительно свидетельствует о том, что эстеразы придают метаболическую устойчивость C. lectularius.
Во втором механизме (качественные изменения) резистентные насекомые могут усиливать опосредованный эстеразой метаболизм за счет единичной точечной мутации или замены в структурных генах. Например, ген LcaE7 овечьей мясной мухи Lucilia cuprina (Wiedemann) кодирует карбоксиэстеразу. Единственная точечная мутация гена LcaE7 изменяет глицин в остатке 137 на аспарагиновую кислоту, а затем превращает карбоксиэстеразу в фосфорорганическую гидролазу, которая придает устойчивость к фосфорорганическим соединениям. Однако во всем мире имеются ограниченные отчеты об этом механизме. Этот механизм все еще является механизмом-кандидатом, и о его влиянии относительно постельных клопов еще не публиковалось.
GSTs – предпологаемый механизм сопротивления клопов
GSTs (глутатион S-трансфераза) опосредуют метаболическую устойчивость к органофосфатам, хлорированным углеводородам и пиретроидам, катализируя конъюгацию электрофильных соединений восстановленным глутатионом (GSH). С другой стороны, GSTs некоторых насекомых катализируют реакцию дегидрохлорирования, используя GSH в качестве кофактора, а не в качестве конъюгата. GSTs также участвуют в детоксикации посредством связывания ксенобиотиков, внутриклеточного транспорта эндогенных липофильных соединений или секвестрации.
Используя биохимические анализы, Karunaratne и коллеги обнаружили, что устойчивость к ДДТ у шри-ланкийского штамма C. hemipterus была связана с высокими уровнями GST, поскольку дегидрохлорирование ДДТ с помощью GSTs является основным путем детоксикации у насекомых. Адельман и другие обнаружили, что один ген GST (gsts1) предположительно связан с устойчивостью к пиретроидам у штамма Richmond C. lectularius из-за повышающей регуляции транскрипции, а три других гена GST были аналогичным образом идентифицированы Mamidala. Дальнейшие исследования трансгенной экспрессии и изучения метаболизма подтвердились у мух-дрозофил, но настоятельно необходимо эмпирически подтвердить этот механизм у постельных клопов.
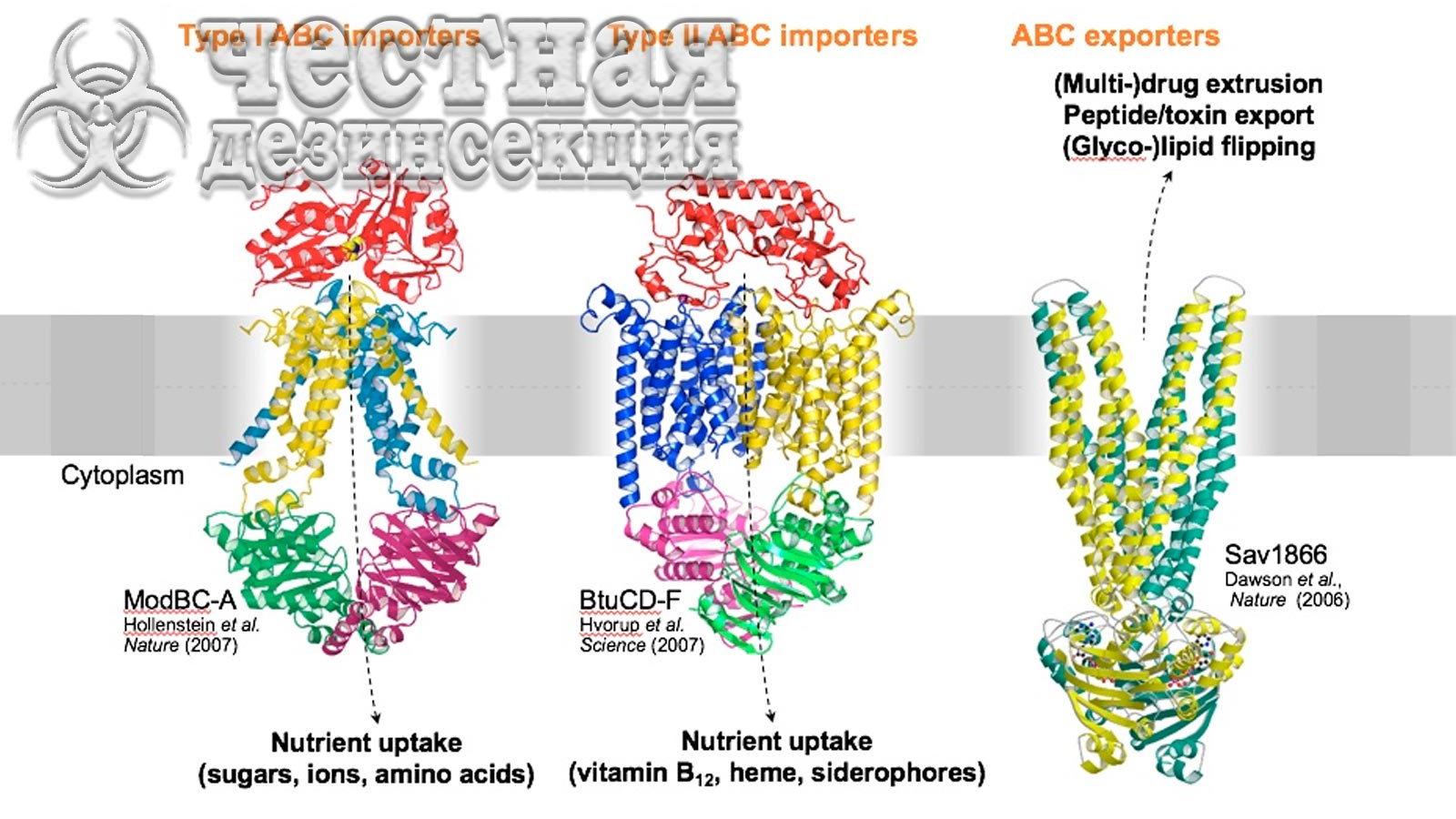
Роль ABC транспортеров в устойчивости постельных клопов
АТФ-связывающие кассетные транспортеры (АВС-транспортеры) представляют собой один из самых больших классов транспортеров, ответственных за транслокацию многих субстратов через мембраны с помощью АТФ. Транспортеры ABC выполняют функцию либо импортеров, которые доставляют питательные вещества и другие молекулы в клетки, либо экспортеров, которые перекачивают токсины, лекарства и липиды через мембраны. Кроме того, было обнаружено, что транспортеры ABC повышают эффективность удаления токсина из целевого участка. Следовательно, транспортеры ABC были связаны с устойчивостью к основным классам инсектицидов (таблица 3), хотя и не связаны напрямую с детоксикацией соединений.
Что касается постельных клопов, Mamidala предположил, что транспортеры ABC были вовлечены в метаболическую резистентность C. lectularius из-за избыточной экспрессии генов, кодирующих транспортеры ABC. Чжу и другие ученые подтвердили роль переносчиков ABC (Abc 8 и Abc 9) в опосредованной метаболической резистентности к пиретроидам (β-цифлутрин) у C. lectularius через РНКи. Кроме того, авторы также определили, что этот механизм широко распространен у полевых популяциях.
Биохимические и молекулярные анализы показали, что P450s, эстеразы и GSTs связаны с устойчивостью к инсектицидам постельных клопов. Исследования синергизма и молекулярные анализы, основанные на РНКи, подтвердили, что P450s и эстеразы, а также ABC-транспортеры опосредуют механизмы устойчивости к пиретроидам у C. lectularius . Однако большинство этих механизмов еще предстоит проверить на C. hemipterus. Кроме того, дальнейшие исследования, специально включающие эксперименты с метаболизмом, чтобы эмпирически продемонстрировать исчезновение исходного соединения и увеличение количества метаболитов у резистентных штаммов, могли бы помочь в выяснении роли этих механизмов у постельных клопов.
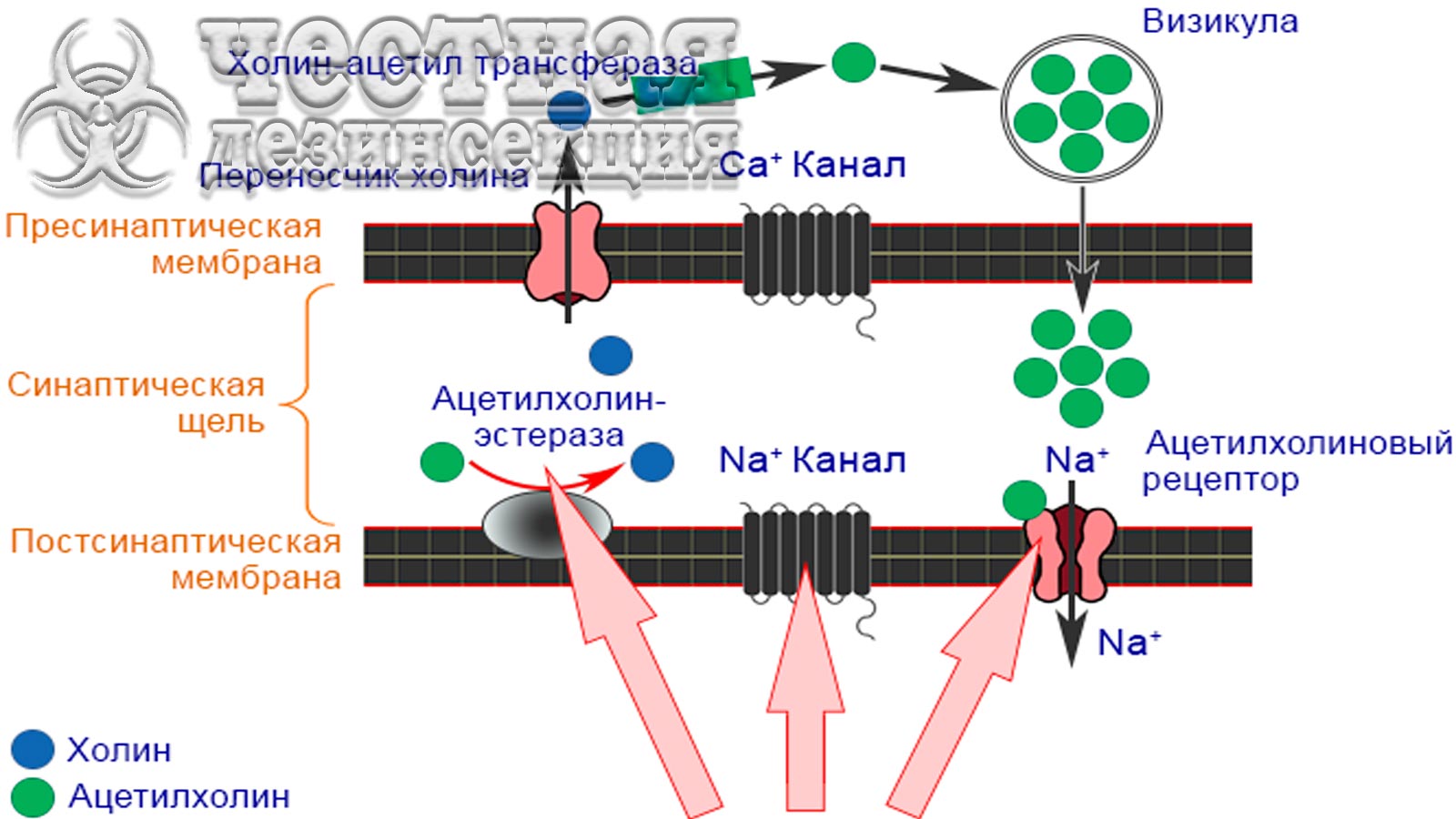
Нечувствительность целевых участков
Инсектициды, такие как ФОС, карбаматы, ДДТ и пиретроиды, воздействуют на определенные участки-мишени (АХЭ – ацетилхолинэстераза, VGSC – натриевый канал, управляемый напряжением, рецептор ГАМК) (таблица 5), которые обычно связаны с нервной системой насекомых. Устойчивые к инсектицидам насекомые развили модификации в этих целевых участках, что позволяет поддерживать нормальную неврологическую функцию, несмотря на присутствие токсиканта. Четыре основных типа механизмов нечувствительности целевого участка у устойчивых насекомых:
- нокдаун-резистентность (kdr-тип), которая вызывает устойчивость к пиретроидам и ДДТ;
- измененные АХЭ, придающие устойчивость к ФОС и карбаматам;
- нечувствительные рецепторы ГАМК (также известные как rdl-мутация), обеспечивающие устойчивость к циклодиенам и фенилпиразолам;
- измененные nAChR, которые придают устойчивость к неоникотиноидам.
kdr – устойчивость постельных клопов к нокдауну
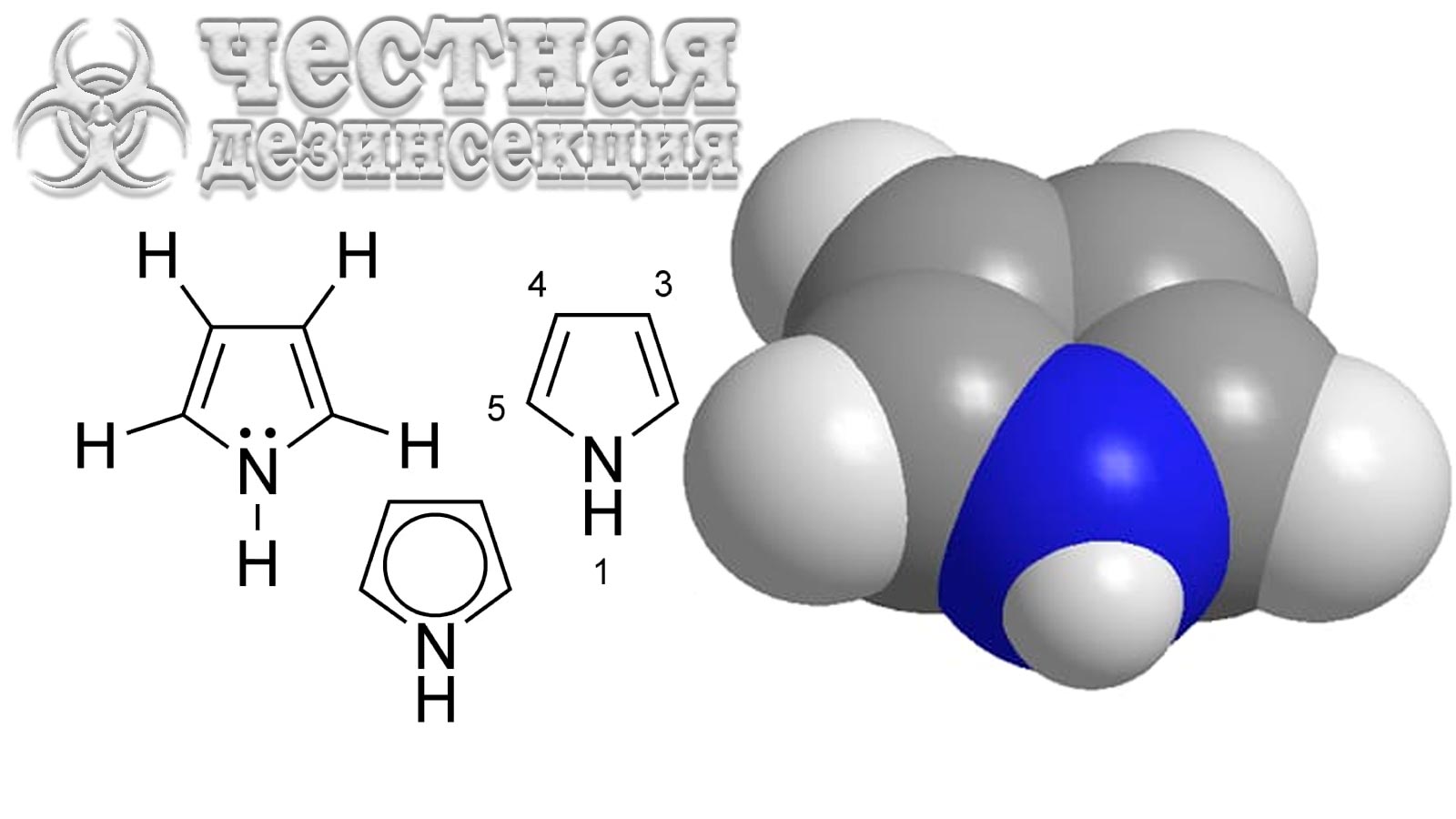
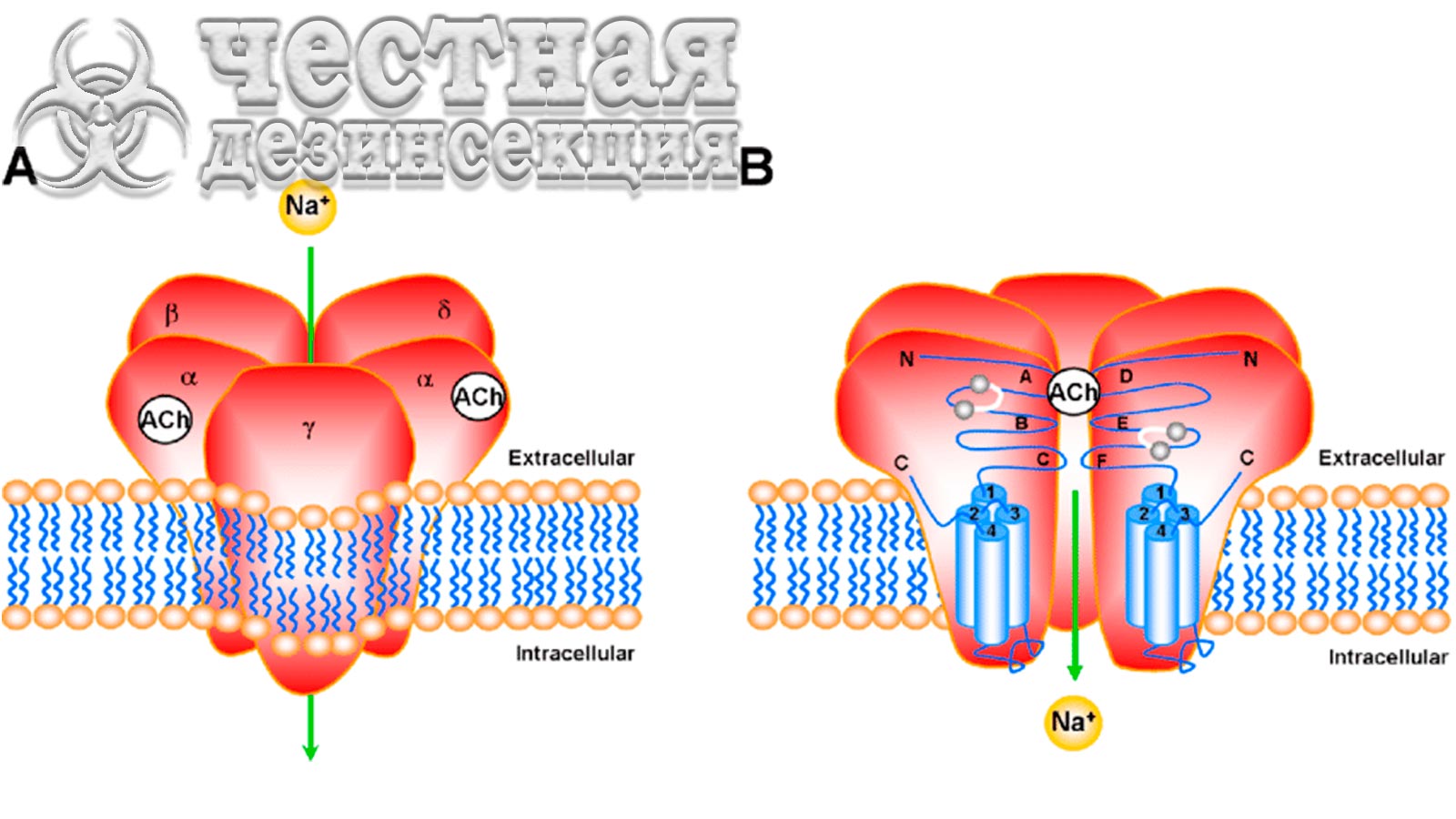
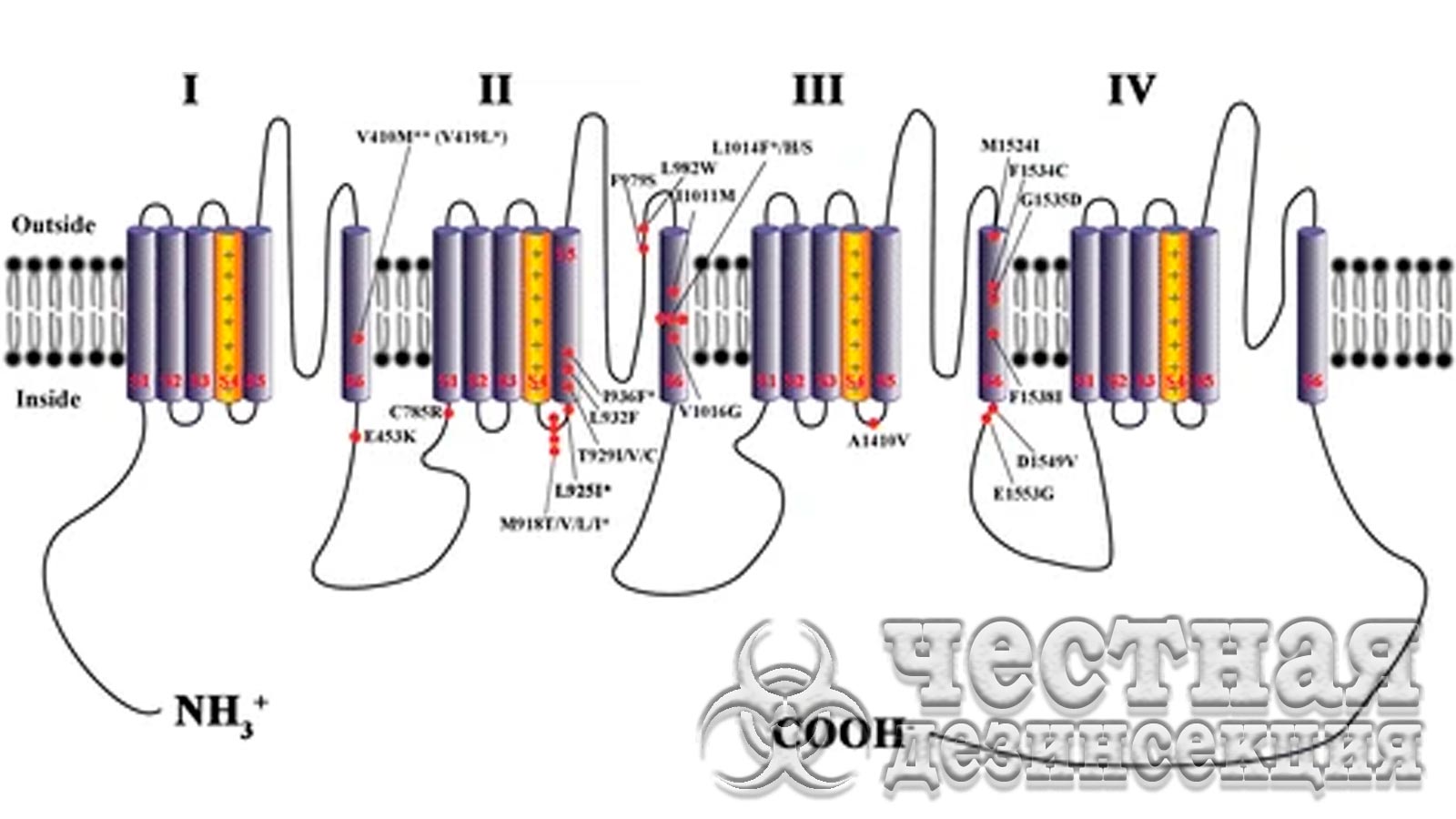
VGSC (Voltage-Gated Sodium Channel – натриевый канал, управляемый напряжением) необходим для нормальной передачи нервных импульсов. ДДТ и пиретроиды действуют на белки VGSC или связываются с ними, нарушая процесс, за которым следует нокдаун, паралич и, в конечном итоге, смерть насекомого. Многие насекомые-вредители развили устойчивость к ДДТ и пиретроидам от умеренной до высокой за счет снижения чувствительности целевого участка (так называемый kdr). Первый случай снижения чувствительности нейронов к ДДТ был зарегистрирован в 1950-х годах у M. domestica. Kdr-резистентность является рецессивным признаком, который придает перекрестную устойчивость к большинству пиретроидов, а также к ДДТ и его аналогам.
Ген VGSC из D. melanogaster первоначально был клонирован и секвенирован в конце 1980-х годов. Это исследование показало, как секвенировать ген VGSC как устойчивых, так и восприимчивых насекомых. Несколько исследований показали, что устойчивость kdr -типа к ДДТ и пиретроидам возникает в результате одной или множественных точечных мутаций (также известных как kdr-мутации) в кодирующих последовательностях VGSC у различных насекомых-вредителей (рис. 2), включая постельных клопов. Юн и др. впервые клонировали и секвенировали кодирующий ген C. lectularius VGSC из штаммов, устойчивых и восприимчивых к инсектицидам. Две мутации kdr (V419L: валин 419 в лейцин и L925I: лейцин 925 в изолейцин) были связаны с приданием устойчивости к пиретроидам у C. lectularius. Было обнаружено, что эти две мутации kdr (одна или обе) широко распространены у C. lectularius (88% из 117 штаммов и 85,7% из 21 штамма в разных исследованиях). Сто процентов испытанных C. lectularius, собранных в Париже и Берлине содержали только L925I. Из C. lectularius, собранных в различных местах Австралии (25 штаммов), 96% содержали L925I, в то время как из Израиля (12 штаммов) 100% имели L925I, из которых несколько образцов из обеих стран имели дополнительный V419L. Основываясь на различных генотипах мутаций V419L и L925I 110 штаммов C. lectularius, собранных в полевых условиях в США. Zhu и коллеги определили четыре гаплотипа:
- гаплотип A (без мутаций V419L и L925I; 15,5%);
- гаплотип B (только L925I; 40,9%);
- гаплотип C (V419L и L925I; 40,9% [45/110]);
- гаплотип D (V419L; 2,7% [3/110]).
Мутации kdr в потенциалзависимых натриевых каналах насекомых, связанные с устойчивостью к пиретроидам/ДДТ. Вся информация о kdr мутации получена от Davies & Williamson, Zhu и Данг. I, II, III и IV – четыре гомологичных повторяющихся трансмембранных домена. Одна звездочка указывает на мутации kdr (или предполагаемые мутации kdr), идентифицированные как у обычного постельного клопа C. lectularius (V419L, валин в лейцин, L925I, лейцин в изолейцин, предполагаемый I936F, изолейцин в фенилаланим), так и в тропическом клопе C. hemipterus .(предполагаемый M918I, метионин в изолейцин; предполагаемый L1014F, лейцин в фенилаланим). Две звездочки: V410, обнаруженный у табачной листовертки Heliothis virescens (F.), и V419, обнаруженный у C. lectularius, представляют собой один и тот же остаток.
Недавно новая мутация I936F (изолейцин 936 в фенилаланин) была идентифицирована в гене VGSC одного штамма C. lectularius, собранного в полевых условиях (из Аделаиды, Австралия), которая была связана с низким уровнем устойчивости к d-аллетрину. Эта новая мутация была также обнаружена в сохраненных в музеях экземплярах C. lectularius , собранных в течение 1994–2002 гг. в четырех разных местах Австралии (4/7), и в одном полевом штамме C. lectularius в Перте (собранном в 2007 г.). Интересно, что в музее сохранились экземпляры, а у штамма Adelaide не было kdr мутации V419L и L925I (гаплотип А). Только штамм Perth имел мутацию L925I (гаплотип B). Новая мутация I936F, вероятно, когда-то была относительно распространена в сохранившихся австралийских образцах C. lectularius (без V419 L и L925I), но в значительной степени исчезла после 2004 г., когда знания о методах борьбы с постельными клопами улучшились. Возможно, что I936F придавал только низкий уровень устойчивости, а популяции с мутацией не выживали, поскольку штамм Adelaide показал относительно более высокую чувствительность к d-аллетрину, чем другие штаммы с L925I или как с V419L, так и с L925I. Хотя мутация I936F обеспечивает низкий уровень устойчивости, она может способствовать развитию других мутаций или других механизмов устойчивости. Выводы о том, что австралийский штамм C. lectularius из Перта имел мутации L925I и мутации L925I и I936F, могут подтверждать этот сценарий.
Другое недавнее исследование выявило четыре новые мутации в генах VGSC C. hemipterus, собранных из нескольких стран, включая:
- Австралию [L899V (лейцин 899 в валин), M918I (метионин 918 в изолейцин), D953G (аспарагиновая кислота 953 в глицин) и L1014F. (лейцин 1014 в фенилаланин)];
- Таиланд (M918I, D953G и L1014F);
- Индия (M918I и L1014F);
- Малайзия (L1014F);
- Кения (L1014F).
Из которых две мутации (M918I и L1014F) были связаны с высокой устойчивостью к пиретроиды у C. hemipterus; однако не исключалось наличие других механизмов резистентности. Известно, что эти два участка придают устойчивость к пиретроидам широкому кругу насекомых-вредителей (рис. 2). Мутации I936F, M918I и L1014F могут быть подтверждены как мутации kdr у постельных клопов посредством функциональной экспрессии каждой мутации по отдельности и в комбинации с использованием системы экспрессии ооцитов Xenopus с двухэлектродной электрофизиологией фиксации напряжения, хотя это еще предстоит выяснить.
Сообщения о различных мутациях в генах VGSC позволяют предположить, что устойчивость к kdr у C. lectularius и C. hemipterus широко распространена. Сонг и др. обнаружили, что уровни устойчивости к дельтаметрину повышались у C. lectularius с увеличением частоты аллеля устойчивости (мутация L925I). Мутация M918I, которая всегда обнаруживалась вместе с мутацией L1014F, вероятно, играет синергетическую роль в усилении устойчивости к пиретроидам у C. hemipterus. Эти результаты могут свидетельствовать о том, что множественные мутации kdr играют значительную роль в устойчивости постельных клопов к пиретроидам и ДДТ.
Примечательно, что мутации kdr, обнаруженные у двух симпатрических видов (Cimex hemipterus и Cimex lectularius), произошли в разных областях генома и не идентичны между двумя видами. В отличие от C. lectularius, мутации kdr у C. hemipterus, вероятно, произошли в результате программ борьбы с малярией (широкое использование пропитанных пиретроидом надкроватных сеток и остаточного распыления ДДТ/пиретроидов на стены в помещениях) в тропиках. Цимекс полужесткокрылый из Кении (с L1014F), Малайзии (L1014F), Индии (M918I и L1014F) имели сходные мутации, которые также были обнаружены у переносчиков малярии Anopheles spp. Наличие мутаций kdr у Anopheles spp. может иметь серьезные последствия для устойчивого использования пиретроидов, особенно когда пиретроиды в настоящее время используются для обработки надкроватных сеток. С другой стороны, мутации могут быть совершенно случайными, и различные мутации kdr, происходящие между Cimex lectularius и Cimex Hemipterus может быть функцией этой случайности и совершенно не связано с использованием конкретного инсектицида.
Измененные ацетилхолинэстеразы как потенциальный механизм резистентности клопов
Первое сообщение о нечувствительности AChEs (АХЭ – ацетилхолинэстеразы) к OPs (ФОС – фосфорорганические соединения) и карбаматам было зарегистрировано у паутинного клеща Tetranychus urticae (Koch), а впоследствии сообщалось о сниженной чувствительности АХЭ как распространенном механизме устойчивости к ФОС/карбаматам у многих видов насекомых.
Генетическое исследование последовательности гена и структуры генома, кодирующих АХЭ (обозначение: Ace) у разных насекомых, показало, что чувствительность к ингибированию снижалась за счет измененных аминокислот, вызванных точечными мутациями в гене Ace, т.е. называют «измененной АХЭ». Например, было обнаружено, что устойчивый к малатиону штамм MH19 D. melanogaster содержит единственную аминокислотную замену F368Y (фенилаланин 368 на тирозин), вызванную точечной мутацией в гене Ace. Было обнаружено, что эта точечная мутация придает устойчивость к малатиону в экспериментах по трансформации Р-элементов. Впоследствии были идентифицированы три другие точечные мутации:
- фенилаланин 115 в серин (F115S);
- изолейцин 199 в треонин/валин (I199T/V);
- глицин 303 в аланин (G303A)] в последовательности гена Ace D. Melanogaster.
Эти мутации у D. melanogaster, связанные с устойчивостью к OPs и карбаматам, были проверены с использованием системы экспрессии ооцитов Xenopus laevis. Кроме того, у других насекомых обнаружены другие мутации в гене, кодирующем АХЭ, которые снижают степень ингибирования инсектицидами. Кроме того, как и kdr резистентность к инсектицидам из-за измененной АХЭ может вызывать широкий спектр перекрестной резистентности между ФОС и карбаматами.
В нескольких исследованиях была выявлена устойчивость к ФОС и карбаматам как у C. lectularius, так и у C. hemipterus. Карунаратне и соавторы сообщили, что 29–44% популяций C. hemipterus в Шри-Ланке показали невосприимчивость к АХЭ в целевом ряде, и это может быть причиной устойчивости как к ФОС, так и к карбаматам.
Недавно Seong и соавторы идентифицировали и охарактеризовали последовательности полноразмерной кДНК, кодирующие две AChE (CAChE1 и CAChE2) из C. lectularius. Хван и другие исследовали молекулярных и ферментативных свойств этих двух АХЭ. Относительно более высокая корреляция между ингибированием ClAChE1 invitro и токсичностью invivo свидетельствует о том, что ClAChE1 является более подходящей токсикологической мишенью для ФОС и карбаматов C. lectularius. Эти результаты дают ценную информацию об изменении резистентности постельных клопов, опосредованной АХЭ, хотя большинство этих инсектицидов-ингибиторов АХЭ были запрещены для использования внутри помещений против насекомых во многих частях мира.
Нечувствительный ГАМК-рецептор – вероятный механизм резистентности постельных клопов
ГАМК-зависимый хлорный канал, также известный как GABA-рецептор, является проверенной мишенью для циклодиена (дильдрина) и фенилпиразола (фипронила). Устойчивость к циклодиенам у некоторых насекомых-вредителей вызывается единственной мутацией [A302S/G: аланин 302 на серин/глицин (остаток 302 у D. melanogaster и остаток 296 у An. gambiae являются одним и тем же остатком)] в ГАМК-рецепторе. Замена аланина 302 влияет на связывания и дестабилизирует предпочтительную конформацию рецептора. Более того, в том же гене была обнаружена дополнительная мутация (V327I: валин в изолейцин), и она была постоянно связана с мутацией A296S (аланин 296 в серин) у резистентных анофелинов.
В нескольких исследованиях была выявлена резистентность к дильдрину как у C. lectularius, так и у C. hemipterus, но и циклодиены, и фенилпиразолы в настоящее время не разрешены законом для использования против постельных клопов в большинстве стран. Недавно было завершено секвенирование генома C. lectularius, и была идентифицирована устойчивость к гену дильдрина (Rdl), кодирующему рецептор ГАМК. Это для циклодиена также является мишенью для фенилпиразолов (фипронила). Таким образом, данные могут дать важный ключ к раскрытию механизма устойчивости нечувствительного рецептора ГАМК как к циклодиенам, так и к фенилпиразолам у постельных клопов в будущем.
Измененные никотиновые ацетилхолиновые рецепторы (nAChR) как возможные механизмы устойчивости клопов
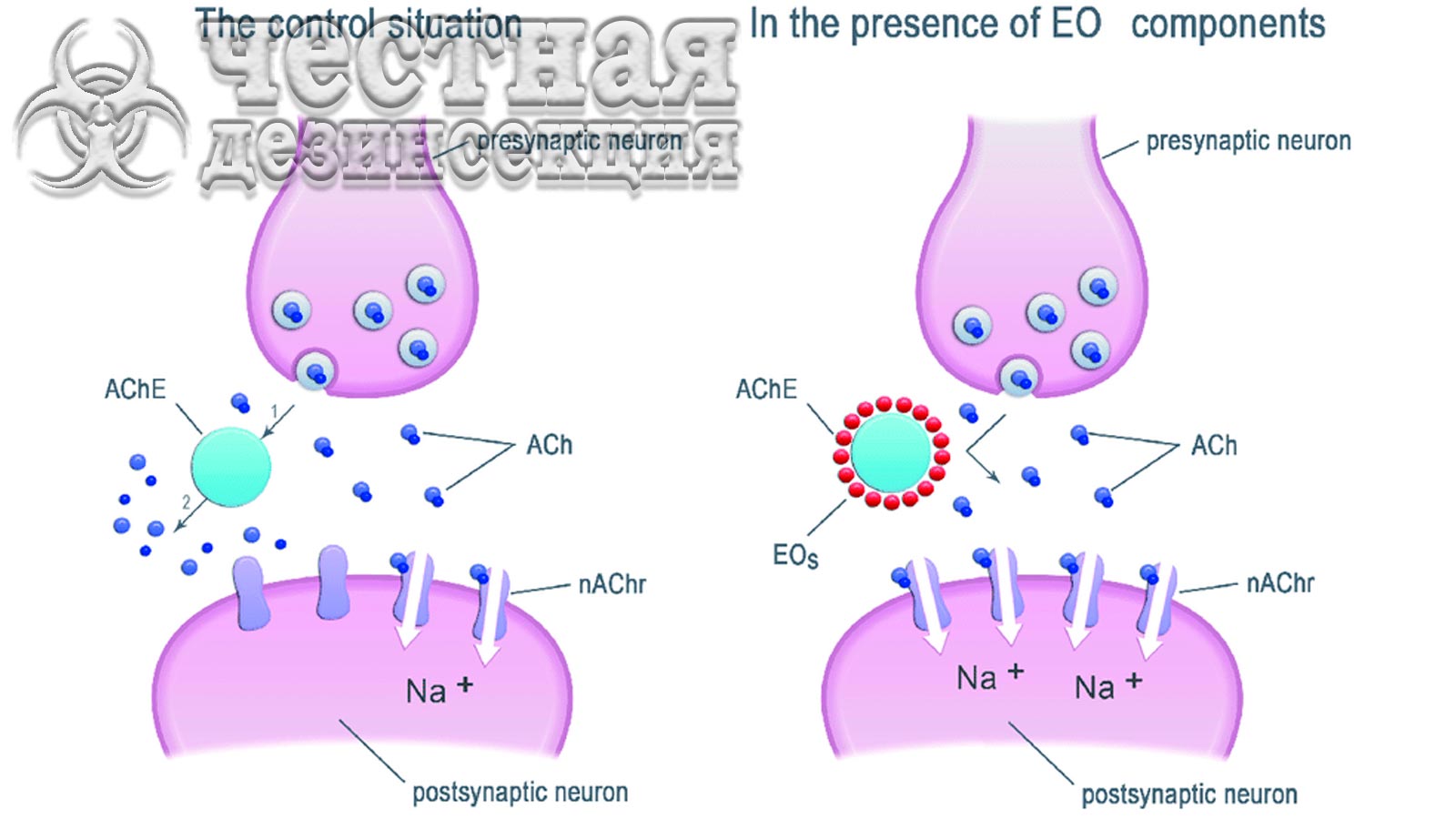
Неоникотиноиды широко используются для борьбы с широким кругом сосущих насекомых-вредителей растений. Неоникотиноиды избирательно действуют на центральную нервную систему насекомых как агонисты nAChR, открывая канал и вызывая непрерывную деполяризацию и возбуждение постсинаптических нейронов, что приводит к параличу и смерти. С увеличением использования неоникотиноидов все чаще сообщается об устойчивости к этим инсектицидам не только из-за механизма метаболической детоксикации, такого как P450s, но также из-за мутации (мутаций) nAChR в мишени. Например, мутация R81T (аргинин 81 на треонин), присутствующая в субъединице β1 nAChR, придает высокий уровень устойчивости к имидаклоприду хлопково-дынной тле Aphis gossypii (Glover) и зеленой персиковой тле Myzus persicae (Sulzer). Совсем недавно Romero & Anderson сообщили о высоких уровнях устойчивости к неоникотиноидам у C. lectularius. Хотя может быть вовлечена метаболическая резистентность, включая общие эстеразы, роль измененного nAChR никогда не подтверждалась у постельных клопов.
Устойчивость клопов к инсектицидам, опосредованная симбионтами (кандидатный механизм)
Симбиотические отношения между животными и микроорганизмами широко распространены в природе. Различные микроорганизмы установили ассоциации с животными-хозяевами посредством паразитизма, мутуализма и комменсализма или путем эктосимбиоза и эндосимбиоза. У насекомых бактериальные симбионты, такие как Wolbachia, обычно связанные с хозяевами, могут манипулировать репродукцией насекомых-хозяев и пищевым мутуализмом. Интересно, что бактериальные симбионты были идентифицированы как участвующие в устойчивости к инсектицидам у некоторых насекомых-вредителей, что называется «симбионт-опосредованной» устойчивостью к инсектицидам. Кикучи и др. обнаружили, что разрушающие фенитротион Burkholderia штаммы эндосимбионтов установили специфический и полезный симбиоз с соевым жуком Riptortus pedestris (F.) и придали устойчивость к фенитротиону. Помимо Burkholderia, различные разрушители фосфорорганических соединений были выделены и охарактеризованы из многих родов бактерий. Кроме того, бактериальные симбионты могут быть вовлечены в устойчивость насекомых к биологическим агентам, таким как Bacillus thuringiensis Berliner и паразитоидная оса Aphidius ervi Haliday. Недавнее исследование показало корреляцию между высокой плотностью бактерий (Arsenophonus, Rickettsia и Wolbachia) у белокрылки Bemisia tabaci (Gennadius) и способность насекомого обезвреживать токсичные соединения, такие как инсектициды (тиаметоксам, имидаклоприд, пирипроксифен и спиромезифен).
Недавно молекулярные исследования выявили различные симбионты, особенно бактериальные симбионты, у постельных клопов, хотя первый эндосимбионт, Rickettsia lectularia Arkwright (Symbiotes lectularius), был обнаружен с помощью световой микроскопии у C. lectularius почти 90 лет назад. Hypsa & Aksoy впервые выделили два симбионта, Wolbachia (альфа-протеобактерия) и BEV-подобный симбионт (безымянная гамма-протеобактерия) из ткани яичника C. lectularius, которые позже были признаны ответственными за управление размножением постельных клопов. Впоследствии было обнаружено, что Wolbachia играет существенную роль в мутуализме питания у C. lectularius. Транскриптомное исследование, проведенное Bai и другими учеными идентифицировали в общей сложности 14,24% транскриптомных последовательностей, не относящихся к насекомым (эукариот, не относящихся к насекомым, 11,16%, грибов, 1,78%, бактерий, 1,21%, вирусов, 0,04%, архей, 0,02% и искусственных последовательностей, 0,03%) у C. lectularius, который, вероятно, относится к различным симбионтам или возбудителям постельных клопов. Фактически, геномное исследование Бенуа и соавт. также продемонстрировали различные последовательности нескольких бактериальных симбионтов и/или возможных патогенов или оппортунистов у C. lectularius, например, Arsenophous, Wolbachia, Sodalis, Hamiltonella, Peptoclostridium, Methanococcus, Serratia, Shewanella и 81 другого рода. Несмотря на наличие множества функциональных симбионтов у постельных клопов, их потенциальная роль в обеспечении устойчивости к инсектицидам до сих пор не документирована и должна быть рассмотрена в будущих исследованиях.
Мониторинг устойчивости постельных клопов к инсектицидам
За последние несколько лет во всем мире было получено много сообщений о резистентности постельных клопов к инсектицидам. Мониторинг статуса резистентности к инсектицидам и механизмов резистентности у постельных клопов является упреждающим и важным подходом для определения надлежащего использования инсектицидов и раннего предупреждения о необходимости изменения стратегий химической борьбы. Были оценены многочисленные исследования методов выявления и документирования устойчивости популяций вредителей к инсектицидам. Тремя основными методами мониторинга устойчивости к инсектицидам являются:
- обычные биоанализы токсичности;
- биохимические анализы;
- молекулярные анализы (таблица 4).
Таблица 4. Методы, используемые для мониторинга устойчивости постельных клопов к инсектицидам
| Метод | Преимущества | Недостатки |
| Биоанализы с помощью анализов доза/концентрация-реакция | Обеспечивает уровни сопротивления | Требуется восприимчивый штамм, нужно большое количество живых постельных клопов; независим от механизма(ов) резистенции |
| Биоанализы посредством дифференциальных анализов концентрации/дозы | Стандартизированные (тестовые наборы ВОЗ на чувствительность); простой в исполнении | Не предоставляет информацию об уровнях резистентности и типе механизма(ов) резистентности (за исключением случаев использования синергистов); отсутствие чувствительности |
| Биохимические анализы | Требует небольшого размера выборки; чувствительный; предоставляет косвенные доказательства специфического механизма(ов) резистентности | Требует сложного и дорогостоящего оборудования и технологий, к которым у борцов с вредителями нет свободного доступа; требуют хранения материалов в замороженном виде |
| Молекулярные анализы | Требует небольшого размера выборки; очень чувствительный; предоставляет информацию о конкретных механизмах резистентности; может обнаруживать аллели резистентности (мутации kdr ) даже в мертвом теле; может разработать специфические молекулярные маркеры для обнаружения специфического механизма (механизмов) | Требуется специальное и дорогостоящее оборудование, высокие текущие расходы и технологии, к которым у борцов с вредителями может не быть доступа; дорогие реагенты, требует хранения материалов в замороженном виде |
Обычные биоанализы токсичности
Стандартный биологический тест, который обычно используется для выявления устойчивости к инсектицидам, включает сбор насекомых с поля и их выращивание до тех пор, пока не будет доступно достаточное количество для тестирования. Затем оценивают смертность нимф или взрослых особей после воздействия ряда доз инсектицида. Затем определяют значения LD 50, LC 50 или LT 50 с использованием пробит-анализа. Затем результаты полевых популяций сравнивают с результатами восприимчивой популяции и рассчитывают коэффициент устойчивости для оценки восприимчивости полевых популяций. Восприимчивость недавно собранных постельных клопов к основным классам инсектицидов (таким как пиретроиды, ФОС, карбаматы и неоникотиноиды) была оценена с помощью биотестов (таблица 5).
Таблица 5. Опубликованные различающие дозы и исходные уровни чувствительности, использованные для выявления резистентности к инсектицидам у постельных клопов
| Инсектицид | Концентрация | Оценка | Базовый уровень восприимчивости | |
| ЛК 50 / ЛД 50 | ЛК 90(99) / ЛД 90(99) | |||
| C. lectularius | ||||
| ДДТа | 4% | 5 д.f | — | — |
| Дильдринa | 0,8% | 2 д.f | — | — |
| Фенитротионb | 1% | 5 ч.f | — | — |
| Малатионb | 5% | 16 ч.f | — | — |
| Трихлорфонb | 1% | 5 ч.f | — | — |
| Пропоксурc | 0,8% | 24 ч.f | — | — |
| Перметринd | 0,25% | Cf | — | — |
| Дельтаметринd | 0,025% | Cf | — | — |
| Дихлофосb | — | 24 ч.f | 2,9 ppm | 5,7 ppm |
| Пиримифос-метилb | — | 24 ч.f | 13,5 ppm | 29,8 ppm |
| λ-цигалотринd | — | 24 ч.f | 22,2 ppm | 357,7 ppm |
| Перметринd | — | 24 ч.f | 71,4 ppm | 201,7 ppm |
| Бендиокарбc | — | 24 ч.f | 47,1 ppm | 95,9 ppm |
| Малатионb | — | 24 ч.f | 92 ppm | 245 ppm |
| Карбарилc | — | 24 ч.f | 166,3 ppm | 245 ppm |
| Тетрахлорвинфосb | — | 24 ч.f | 252 ppm | 472,7 ppm |
| Бендиокарбc | 35,3 M | 48 ч.f | — | 35,3 M |
| α-циперметринd | 23,1 M | 48 ч.f | — | 23,1 M |
| Дельтаметринd | 0,06% | Cg | — | — |
| Дельтаметринd | 1300 М (30 × LC 99 ) | 24 ч.f | 3,1 M | 44 M |
| λ-цигалотринd | — | 24 ч.f | 2,16 M | 66 M |
| Дельтаметринd | 1% | Cf | — | — |
| Дельтаметринd | — | 24 ч.f | 1,4 M | 19,2 M |
| Бендиокарбc | — | 24 ч.f | 6,5 M | 38,1 M |
| Пиримфос-метилb | — | T, 24 ч. | 0,11 U | — |
| Имидаклопридe | — | T, 24 ч. | 0,0057 U | — |
| Бендиокарбc | — | T, 24 ч. | 0,027 U | — |
| Перметринd | — | T, 24 ч. | 0,00044 U | — |
| Дельтаметринd | — | T, 24 ч. | 0,00057 U | — |
| Дельтаметринd | — | 1 ч.f | 18,1 ppm | 81,8 ppm |
| Дельтаметринd | 12 ч.f | 3,2 ppm | 26 ppm | |
| λ-цигалотринd | 1 ч.f | 17,7 ppm | 87 ppm | |
| λ-цигалотринd | 12 ч.f | 3,4 ppm | 30 ppm | |
| Дельтаметринd | 1300 М (30 × LC 99 ) | 24 ч.f | — | — |
| Дельтаметринd | — | IT, 24 ч.h | 0,00003 U | — |
| β-цифлутринd | — | IT, 24 ч.h | 0,00004 U | — |
| ДДТa | 4% | Cf | — | — |
| Дильдринa | 0,8% | Cf | — | — |
| Бендиокарбc | 0,1% | Cf | — | — |
| Пропоксурc | 0,1% | Cf | — | — |
| Малатионb | 5% | Cf | — | — |
| Фенитротионb | 1% | Cf | — | — |
| Цифлутринd | 0,15% | Cf | — | — |
| Дельтаметринd | 0,05% | Cf | — | — |
| Перметринd | 0,75% | Cf | — | — |
| λ-цигалотринd | 0,05% | Cf | — | — |
| Этофенпроксd | 0,5% | Cf | — | — |
| Перметринd | 2,56 U (1,6 × LC 99 ) | Т, 24/48 ч. | 0,159 U | 1,65 U |
| Перметринd | 57,6 M | 40 мин.h | — | — |
| Дельтаметринd | 19,6 M | 40 мин.h | — | — |
| Хлорпирифосb | 0,2 U (2 × LC 99 ) | Т, 24/48 ч. | 0,03 U | 0,1 U |
| Хлорпирифосb | 53 M | 40 мин.h | — | — |
| Малатионb | 0,007% (2 × LC95) | T | — | — |
| Диазинонb | 0,02% (2 × LC95) | T | — | — |
| Трихлорфонb | 1,4% (2 × LC95) | T | — | — |
| Хлорпирифосb | 0,014% (2 × LC95) | T | — | — |
| Перметринd | 0,03% (2 × LC95) | T | — | — |
| Циперметринd | 0,00008% (2 × LC95) | T | — | — |
| α-циперметринd | 0,000001% (2 × LC95) | T | — | — |
| Дельтаметринd | 0,00008% (2 × LC95) | T | — | — |
| λ-цигалотринd | 0,00005% (2 × LC95) | T | — | — |
| Имидаклопридe | 0,0015% (2 × LC95) | T | — | — |
| Ацетамипридe | 0,0044% (2 × LC95) | T | — | — |
| Дельтаметринd | 1300 M (30 × LC99) | 24 ч.f | — | — |
| Дельтаметринd | 0,06 U (100 × LD50) | Т, 24 ч. | 0,0006 U | — |
| Дельтаметринd | — | 24 ч.f | 30 M | — |
| Дельтаметринd | — | T | 0,0004 U | — |
| β-цифутринd | — | T | 0,00308 U | — |
| Дельтаметринd | — | 24 ч.f | 2,58 M | — |
| d-аллетринd | 40 mg/mat | 24 ч.i | — | — |
| Имидаклопридe | — | Т, 72 ч. | 0,0023 U | — |
| Ацетамипридe | — | Т, 72 ч. | 0,0003 U | — |
| Тиаметоксамe | — | Т, 72 ч. | 0,0019 U | — |
| Динотефуранe | — | Т, 72 ч. | 0,0145 U | — |
| C. hemipterus | ||||
| ДДТa | 2% | 1 часf | — | — |
| α-циперметринd | 20 M | 72 ч.j | — | — |
| Перметринd | 200 M | 72 ч.j | — | — |
| Перметринd | 0,75% | 72 ч.f | — | — |
| ДДТa | 2% | 24 ч.f | — | — |
| Малатионb | 5% | 16 ч.f | — | — |
| Пропоксурc | 0,8% | 24 ч.f | — | — |
| Дельтаметринd | 0,025% | Cf | — | — |
| Перметринd | 0,25% | Cf | — | — |
| ДДТa | 4% | Cf | — | — |
| Дильдринa | 0,8% | Cf | — | — |
| Бендиокарбc | 0,1% | Cf | — | — |
| Пропоксурc | 0,1% | Cf | — | — |
| Малатионb | 5% | Cf | — | — |
| Фенитротионb | 1% | Cf | — | — |
| Цифлутринd | 0,15% | Cf | — | — |
| Дельтаметринd | 0,05% | Cf | — | — |
| Перметринd | 0,75% | Cf | — | — |
| λ-цигалотринd | 0,05% | Cf | — | — |
| Этофенпроксd | 0,5% | Cf | — | — |
| d-аллетринd | 40 mg/mat | 24 ч.i | — | — |
T — местное применение
IT — инъекция
C — непрерывное воздействие
—
мин. — минут
ч. — часов
д. — дней
M — mg AI m−2
U — μg μL−1 или μg insect−1
—
a — Хлорированные углеводороды
b — Фосфорорганические соединения
c — Карбаматы
d — Пиретроиды
e — Неоникотиноиды
f — Поверхностный контакт с фильтровальной бумагой
g — Поверхностный контакт на панелях из твердого картона
h — Поверхностный контакт на стеклянных пластинах
i — Поверхностный контакт с москитным ковриком
j — Поверхностный контакт с сеткой
Тем не менее, биопробы могут быть трудными для проведения. Обычно для этого метода требуется относительно большое количество живых постельных клопов для теста, и получить такое количество не всегда возможно, особенно когда количество постельных клопов, собранных при полевых заражениях, может быть относительно небольшим. Кроме того, для сравнения требуется стандартный восприимчивый штамм, но многие организации не имеют доступа к такому штамму. Несколько восприимчивых штаммов C. lectularius хранятся в лабораториях по всему миру, например:
- штамм Dix (= штамм Harlan, создан в 1973 г.);
- штамм FL-BB (начало 1990-х гг.);
- штамм LA-1 (2006 г.);
- штамм UBA Федерального агентства по охране окружающей среды (с 1947 г.);
- штамм Monheim (Германия) (конец 1960-х гг.).
Но на сегодняшний день восприимчивых штаммов C. hemipterus нет. Другие традиционные биоанализы, такие как использование различающих концентраций, основанных на предыдущих исследованиях кривых доза-реакция восприимчивых штаммов, могут быть альтернативным вариантом, если нет восприимчивого штамма или достаточного количества живых клопов для тестирования. Однако одна различающая доза может указывать только на наличие резистентности, но не на степень резистентности.
Мониторинг устойчивости к инсектицидам в большинстве случаев зависит от традиционных биотестов, в которых используется фиксированная концентрация инсектицида (например, дискриминационная/диагностическая концентрация) в течение заранее определенного времени воздействия в камере или на фильтровальной бумаге, пропитанной инсектицидами. Результаты представлены в виде процентной смертности и/или нокдаун-эффекта. Например, диагностическая концентрация (или тест-набор ВОЗ на чувствительность), установленная Всемирной организацией здравоохранения (например, удвоенная концентрация/доза, которая убивает 100% восприимчивого штамма насекомых), широко используется для определения чувствительности или устойчивости к основным классы инсектицидов у комаров-переносчиков. В нескольких исследованиях изучалась устойчивость постельных клопов с использованием этого метода (таблица 5). Мямба и др. адаптировали набор ВОЗ для тестирования комаров для выявления устойчивости к пиретроидам у C. hemipterus в Танзании. Карунаратне и др. также адаптировали метод ВОЗ для определения устойчивости к нескольким инсектицидам у C. hemipterus в Шри-Ланке. Тавацин и др. исследовали устойчивость к инсектицидам как Cimex lectularius, так и Cimex hemipterus в Таиланде, используя тест-набор ВОЗ.
Подобно методам ВОЗ, во многих исследованиях были установлены базовые данные о чувствительности (LC 99 /LD 99 ) для инсектицидов, которые приводят к 99% или более смертности восприимчивых штаммов постельных клопов (таблица 5). Эти данные могут служить ориентиром для выбора отличительных концентраций для выявления устойчивости постельных клопов к инсектицидам даже при отсутствии восприимчивого штамма. Например, исследователь Боаз и др. установили две разные различающиеся концентрации, которые вызывали 99% смертность у трех восприимчивых C. lectularius штаммов в Соединенном Королевстве для выявления устойчивости к бендиокарбу (карбаматам) и альфа-циперметрину (пиретроидам) соответственно. Ромеро и др. использовали различающую концентрацию (в 10 раз превышающую указанную норму активного ингредиента в коммерческом продукте и почти в 30 раз превышающую дозу, необходимую для уничтожения 100% чувствительного штамма Ft. Dix C. lectularius) для оценки устойчивости к дельтаметрин у C. lectularius с третьего по пятый возраст в 10 популяциях, собранных в полевых условиях. Чжу и др. также использовали эту отличительную концентрацию для оценки устойчивости к пиретроидам в 17 популяциях C. lectularius. Килпинен и другие ученые определил C. Lectularius устойчивость к перметрину при дискриминирующей концентрации 1,6-кратной LD 99 и хлорпирифосу при концентрации 2-кратной LD 99 соответственно. Однако, если используемые различающие концентрации чрезмерно высоки, это потенциально может замаскировать обнаружение устойчивости, особенно когда уровень устойчивости все еще относительно низок. Раннее выявление резистентности возможно только в том случае, если диагностическая концентрация достаточно низка (или построена кривая доза-эффект). В противном случае резистентность может быть обнаружена только после сообщений о массовых сбоях.
После определения статуса резистентности следует охарактеризовать механизмы резистентности. Для выявления некоторых механизмов метаболической резистентности можно использовать быстрый и простой биоанализ в сочетании с синергистами. Синергисты служат ингибиторами ферментов метаболической детоксикации, таких как эстеразы, P450s и GSTs (таблица 8). Биопробы, включающие синергисты, широко использовались для определения роли различных механизмов устойчивости у многих насекомых-вредителей. Например, синергисты, такие как PBO, были включены в борьбу с постельными клопами и для выявления потенциальных механизмов устойчивости. Однако не все механизмы резистентности можно охарактеризовать с помощью синергистов. Следовательно, биохимические анализы и молекулярные анализы должны использоваться наряду с биоанализами инсектицидов для выявления специфических механизмов устойчивости (таблицы 4 и 7).
Таблица 6. Синергисты как ингибиторы основных ферментов метаболической детоксикации
| Ферменты детоксикации инсектицидов | Синергисты / ингибиторы |
| Монооксигеназы цитохрома P450 (P450s) | PBO, sesamex |
| Эстеразы | EN16/5–1, DEF, TPP, IBP, K-1, K-2, sesamex, и SV-1 |
| Глутатион-S-трансферазы (GSTs) | DEM, EA и CF |
Сокращения:
DEF SSS-трибутлифосфоротритиоат
TPP трифенилфосфат
IBP S-бензилдиизопропилфосфотиолат
K-1 (2-фенил-4H-1,3,2-бензодиоксафосфотиолат)
K-2 2-фенокси-4H-1,3, 2-бензодиоксафосфорин 2-оксид
sesamex 5-[1-[2-(2-этоксиэтокси)этокси]этокси]-1,3-бензодиоксол
SV-1 , O,O-диэтил-O-фенилфосфотиолат
DEM — диэтилмалеат
EA — этакриновая кислота
CF — хлорфенетол
Биохимические анализы для мониторинга резистентности клопов
В биохимических анализах используются модельные субстраты для обнаружения повышенной активности метаболических ферментов, участвующих в устойчивости к инсектицидам у отдельных насекомых. За последние два десятилетия биохимические анализы успешно использовались для обнаружения и мониторинга резистентности к инсектицидам у многочисленных насекомых, особенно в сочетании с биоанализом инсектицидов. Карунаратне и др. изучали резистентность к инсектицидам и потенциальные механизмы резистентности у C. hemipterus из Шри-Ланки на основе биотестов токсичности и биохимических анализов. Они обнаружили, что C. Hemipterus показали высокие уровни устойчивости к ДДТ и малатиону, а также выявили повышенные уровни GSTs и эстераз. Юн и др. использовали биохимические анализы для выявления механизмов резистентности, ответственных за невосприимчивость к дельтаметрину у штамма New York C. lectularius, хотя не было выявлено различий в активности оцениваемых ферментов. Адельман и коллеги также использовали биохимические анализы для определения дифференциальной активности ферментов детоксикации, которые предположили, что метаболическая резистентность, вероятно, была связана с устойчивостью к пиретроидам у C. lectularius. Romero & Anderson оценили активность ферментов метаболической детоксикации (P450s, GSTs и эстераз) у C. lectularius. с помощью биохимических тестов. Они обнаружили, что метаболическая устойчивость, вероятно, связана с невосприимчивостью к неоникотиноидам. Однако важно уточнить, что наличие повышенных уровней ферментов само по себе не является прямым доказательством их участия в качестве механизмов резистентности, если только исследования метаболизма и/или синергизма invivo не показали, что эти ферменты были вовлечены.
Таблица 7. Опубликованные молекулярные маркеры генов, предположительно участвующих в механизмах устойчивости постельных клопов
| Механизм резистентности | Ген | Молекулярный анализ | Последовательность праймеров (5’~3′) |
| kdr мутация | V419 L | PCR and sequencing | F: AACCTGGATATACATGCCTTCAAGG; R: TGATGGAGATTTTGCCACTGATG |
| L925; I936F | PCR and sequencing | F: GGAATTGAAGCTGCCATGAAGTTG; R: TGCCTATTCTGTCGAAAGCCTCAG |
|
| V419L | AS-PCR | F(V): ATTCCTGGGATCATTCTACCTCg; F(L): ATTCCTGGGATCATTCTACCTCc; R: TGATGGAGATTTTGCCACTGATG |
|
| L925I | AS-PCR | F(L): ATTATGGGCAGAACAGTGGGTGCCc; F(I): ATTATGGGCAGAACAGTGGGTGCCa; R: TGCCTATTCTGTCGAAAGCCTCAG |
|
| V419L | QS | F: GTCCGTGGCACATGTTGTTCTTCA; R: CTGATGGAGATTTTGCCACTGATGC; R: CCTCTTCAGCAGCTTCTTCTTCTTC (для секвенирования) |
|
| L925I | QS | F: GGTCTATCAGTTTTGAGGTCATTCAG; R: GGAGTTCGCCATCAGGGAATCTAT; F: GTGTTTAAGCTGGCTAAGTCATGGCC (для секвенирования) |
|
| M918I; L1014F | PCR and sequencing | F: GGAATTGAAGCTGCCATGAAGTTG; R: TGCCTATTCTGTCGAAAGCCTCAG |
|
| Сопротивление проникновению | Contig_1766 (CDA) | qRT-PCR | F: TGAATGCTATAAGAATCGTA; R: ATTACCAATACACCAACAA |
| Contig_1762 (CHS) | qRT-PCR | F: TAATGAAGCAAGGCACTA; R: AATACTCCACACGATACC |
|
| Contig_48951 (CPAP) | qRT-PCR | F: GTCCTCAGCACCAATCGT; R: GTTGTTGGAACTGTTGTTGATG |
|
| Contig_17694 (LCP) | qRT-PCR | F: GCCACTACTATAACAGAG; R: ATTACCTCCAAGATTGAAT |
|
| Contig_21630 (PCP) | qRT-PCR | F: CCAGATAATTCAAGAGATG; R: AGTCTAATCGGTCTATATG |
|
| Contig_24229 | qRT-PCR | F: CGCCAGGGCCGAGGAGTATG; R: ACGGGGTCGGCGGTGTAGTCT |
|
| Contig_24231 | qRT-PCR | F: CGACGATCATCCCCAATACAGTTT; R: AGGGGCGGCTTTAGCGACCACA |
|
| Contig_24227 | qRT-PCR | F: TTTCTTTTGGCAGCTTTGGTTGTA; R: CCTGCTTTCGGTCTGGGATTTG |
|
| Contig_24230 | qRT-PCR | F: GACTACTACGCCCACCCGAAATAC; R: GTGAGCAGCGTGGCCAGTCTTGTG |
|
| Contig_24228 | qRT-PCR | F: TCCCGCTGTTACCAAGACTCAATG; R: GCCAAAGCGACTGCAGGTGTATC |
|
| Contig_2034 | qRT-PCR | F: TACCGTTAATGCTGCTACACCAA; R: TCCCGAGGCGACGAAACCACT |
|
| Contig_1629 | qRT-PCR | F: AGGCCAGTCCAACACAACCAAC; R: TGCTGCCGTCCTCATTCTCC |
|
| Contig_3037 | qRT-PCR | F: ACGGCAGGATGGTCGAAGATTATG; R: AGGACGAGGGGCGGGCTGTGGT |
|
| Contig_2322 | qRT-PCR | F: CGAACCTGCCGGAAGTGACATAAA; R: TTGCGGCTGGTAGTACTGAGGTTG |
|
| Contig_773 | qRT-PCR | F: GCCGTTGAGCAGCAGCGATAA; R: CGTGGGGCGGAAGAAGGATT |
|
| Contig_2220 | qRT-PCR | F: ATGGCACCAGGAGGGGAACTTA; R: GGTACTGGGGCTGGGCTCTGT |
|
| Contig_1833 | qRT-PCR | F: ACAATTCGGTGGTGCCCCTTTCT; R: TCGGCGACGTAGCTGACCTGGAC |
|
| Contig_820 | qRT-PCR | F: ATCAGCAGCCAAGTCGTAGGAAGC; R: GGAGGGGTTGGGAGGTGGTCT |
|
| Contig_934 | qRT-PCR | F: ACACCACTCCCGTTCCCATCGTC; R: CGTTCTCGTCGGCGGTGTAAGTCA |
|
| Contig_2492 | qRT-PCR | F: CGGTATCTCGGCGAAGGAACAG; R: GCGGCGTAGGGAGATGAGCA |
|
| Contig_22513 | qRT-PCR | F: CGACGGAACATACAACTGGGAATA; R: GTCGGCGGTGTAGGTCAACTGGAT |
|
| Contig_15313 | qRT-PCR | F: ACGGAACCCATCCCGATCCTTAAA; R: ATGCCGTTACCGGTTTCGTATTCC |
|
| Contig_02621 | qRT-PCR | F: ACTCCTGAAGTCCAAGCAGCAAGA; R: TCGGAAGGGTTGTCCAAATCGTGA |
|
| Contig_8158 | qRT-PCR | F: CCAAGCGGTCAAAGCAGCACATTT; R: AGCCTAGCGAGAGCTTGGTTGTAA |
|
| Метаболическая резистентность | CYP9 (Contig No.: N/A) | qRT-PCR | N/A |
| CYP6DM2 (Contig No.: N/A) | qRT-PCR | F: CCCCCTTATGCTACCCGTTTGA; R: TTCGTCCTTTTTATGTCCGTCTGC |
|
| CYP397A1 (Contig No.: N/A) | qRT-PCR | F: CTCGGGCTCACCACTCTCAACA; R: ACCGTCATGGCTCCCGTCAG |
|
| CYP400A1 (Contig No.: N/A) | qRT-PCR | F: CCTGCGCGTTCGGAGTCAATA; R: CATCGGCTAAATAGAGGAAAAAGT |
|
| Contig_19601 (CYP397A1V2) | qRT-PCR | F: TCGGAGGAATGGAAGAAG; R: CGTCATGGTATGGATGGT |
|
| Contig_103 (CYP6A2) | qRT-PCR | F: AAGTTGTCCTAGAGTGTT; R: GAGATATGCGTGAATGTC |
|
| Contig_22399 (CYP6A13) | qRT-PCR | F: CGTCATGGTATGGATGGT; R: TCGGAGGAATGGAAGAAG |
|
| Contig_11345 (CYP397A1) | qRT-PCR | F: TATTGGAGTCGACAGGGCGTGAAA; R: TGACATCGCCCAATTGCTTGTAGC |
|
| Contig_03764 (CYP398A1) | qRT-PCR | F: TGTCGACCCAATGATGGCTCTGAA; R: GAAATTGGAGGCCGATTTGGCGAT |
|
| Contig_04490 (CYP6DN1) | qRT-PCR | F: GCGAGTCTGGGAAATTGTGCATGAAT; R: AATGCCCGATTACGATGTCAGGGA |
|
| Contig_04099 (CYP4CM1) | qRT-PCR | F: ATTGGTAACATTGGAGGCCCTGGA; R: AGAGATTTGCCTTACCACCAGCGA |
|
| ClCPR (Contig No. N/A) | qRT-PCR | F: TATGCCGCAGAATACGGACAACTC; R: ACCTGCAAATTCTTCACCAGTGCC |
|
| Эстеразы | CE3959 (Contig No. N/A) | qRT-PCR | F: ACGTCTGGAGAAGGGCAACTGAAA; R: GACGGCCGGGTAGATGAAAACAAC |
| CE21331 (Contig_03262) | qRT-PCR | F: TCTCACGGGGACGAACTGCCTTAT; R: CCTGGTCTTCTGGGTATTTCTTCA |
|
| GSTs | gsts 1 (Contig No. N/A) | qRT-PCR | F: AGGAGAGCCAGTTAGATTTATGTT; R: AAGCGATTCCCACCGATTTT |
| ABC- транспортеры | Contig_1346 | qRT-PCR | F: TGCTCTACATAATTCTGACAT; R: GTAGGACGGTATGAGGTA |
| Contig_08506 (Abc8) | qRT-PCR | F: ATCCTGATGGGCCGAGTAAACCAT; R: TTCTGGAGGTGACCGTCAAGTTGT |
|
| Contig_02154 (Abc9) | qRT-PCR | F: TTTAGCAACCGATGTGACGCAAGC; R: TGACCCAGACGTTGTCAACACAGA |
|
| Contig_05955 (Abc10) | qRT-PCR | F: TCACAGCGGTCTTCCTGGATTCTT; R: AACTTCTGCGCGCACATTAGAACG |
|
| Contig_09403 (Abc11) | qRT-PCR | F: ATGCAGCTCAGTAGGGTCGTCTTT; R: CGGGCCAAAGTCAAATCAGCACAT |
Сокращения:
N/A — неприменимо
AS-PCR — аллель-специфическая ПЦР
PCR (ПЦР) — полимеразная цепная реакция
QS — количественное секвенирование
qRT-PCR — количественная ПЦР в реальном времени
F — прямой праймер
R — обратный праймер
Молекулярные анализы при мониторинге устойчивости постельных клопов
Выявление устойчивости к инсектицидам с помощью молекулярных анализов может обеспечить раннее предупреждение о развитии устойчивости к инсектицидам и специфический механизм устойчивости, что позволит более точно определиться с выбором инсектицидов. Например, мутации устойчивости к kdr могут быть выявлены у многих насекомых, устойчивых к ДДТ и/или пиретроидам. Для обнаружения kdr было разработано несколько молекулярных анализов мутаций, таких как прямой анализ ДНК-секвенирования, аллель-специфическая ПЦР (AS-PCR), анализ лигирования олигонуклеотидов с подогревом (HOLA), иммуноферментный анализ, связанный с олигонуклеотидным зондом (SSOP-ELISA), ПЦР-дот-блоттинг, энергия флуоресцентного резонанса Анализ кривой переноса/плавления (FRET/MCA), анализ расплава высокого разрешения (HRM) и ПЦР TaqMan в реальном времени для ряда насекомых-вредителей, включая постельных клопов (таблица 7). Прямой анализ секвенирования ДНК, включая QS (количественное секвенирование) является наиболее распространенным молекулярным анализом, используемым для идентификации мутаций kdr (V419L, L925I) в штаммах постельных клопов, собранных в полевых условиях (таблица 7). Однако этот анализ не применим для изучения крупных популяций. Другие анализы, такие как AS-PCR, могут быть использованы для обнаружения мутаций kdr в штаммах, собранных в полевых условиях (таблица 7). Как отмечают Bass и коллеги следует разработать более чувствительный и специфичный молекулярный анализ (например, TaqMan ПЦР в реальном времени) для выявления мутаций kdr.
Недавние транскриптомные и геномные исследования популяций постельных клопов показали, что в популяциях постельных клопов могут присутствовать множественные гены-кандидаты, которые предположительно опосредуют механизмы устойчивости (таблица 1). В этих исследованиях сверхэкспрессия генов, кодирующих метаболические ферменты (P450s, эстеразы и GSTs), и генов, кодирующих кутикулярные белки для утолщения или ремоделирования кутикулы с целью снижения скорости проникновения инсектицидов, использовалась в качестве дискриминационных критериев для выявления генов, которые, вероятно, связаны с устойчивостью к инсектицидам, особенно с устойчивостью к пиретроидам у постельных клопов, хотя они нуждаются в дальнейшей экспериментальной проверке. На основе количественной технологии RT-PCR было разработано множество молекулярных маркеров для мониторинга этих предполагаемых генов, связанных с устойчивостью, на основе этих исследований (таблица 7). Кроме того, методы РНК-интерференции также обеспечивают многообещающий подход для дальнейшей проверки генов, которые управляют устойчивостью у постельных клопов. Наконец, другие подходы, такие как трансгенная экспрессия и исследования метаболизма, могут быть проведены для непосредственной проверки генов, управляющих устойчивостью у постельных клопов.
Выводы касательно увеличения численности постельных клопов и их резистентности
За последние два десятилетия постельные клопы пережили серьезное возрождение во всем мире. Широко распространенное присутствие резистентности к инсектицидам в популяциях полевых клопов может быть единственным наиболее важным фактором, ответственным за возрождение постельных клопов. Транскриптомные и геномные исследования в последние годы произвели значительную революцию в исследованиях устойчивости постельных клопов к инсектицидам. С резистентностью постельных клопов к инсектицидам предположительно связаны многочисленные физиологические механизмы. Эти механизмы включают:
- снижение проникновения за счет утолщения или ремоделирования кутикулы (активация генов белков, связанных с кутикулой);
- метаболическую резистентность (повышенную метаболическую активность ферментов детоксикации);
- нечувствительность мишени (kdr мутации).
Тем не менее, участие большинства генов-кандидатов, связанных с устойчивостью к инсектицидам, обнаруженных с помощью транскриптомных и геномных подходов, все еще нуждается в проверке с помощью эмпирических функциональных подходов, таких как:
- РНК-интерференция;
- функциональная характеристика генов;
- исследования метаболизма/биотрансформации;
- нейрофизиологические исследования.
Упомянутый здесь прогресс в понимании механизмов устойчивости к инсектицидам в основном сосредоточен на обыкновенном постельном клопе C. lectularius. Мало что известно о механизмах устойчивости тропических постельных клопов C. hemipterus к инсектицидам, хотя они, вероятно, имеют схожие механизмы. Методы биоанализа относительно просты в применении и предоставляют стандартизированные данные для мониторинга устойчивости к инсектицидам. Однако они имеют ряд практических ограничений. Например, для биоанализа требуется чувствительный штамм для сравнения и большое количество насекомых для тестирования. В идеале биохимические, молекулярные анализы и биологические анализы инсектицидов можно проводить совместно для выявления устойчивости к инсектицидам и ее механизмов. Последние два анализа имеют преимущества, так как требуют меньшего размера выборки и могут точно идентифицировать ген(ы), которые связаны с механизмами резистентности. Однако для проведения этих анализов требуется сложное и дорогостоящее оборудование и реагенты, которые могут быть недоступны в развивающихся странах.